Первым этапом лечения всех опухолей яичка является орхфуникулэктомия, во время которой удаляется яичко с семенным канатиком. При несеминомных герминогенных опухолях яичка (НГОЯ) дальнейшая тактика лечения определяется гистологическим строением, уровнем опухолевых маркеров до и после орхфуникулэктомии, стадией заболевания.
Повышение уровня альфа-фетопротеина (АФП) отмечается у 50%-70%, бетта-хорионического гонадотропина (ХГ) - у 40%-60% больных НГОЯ. Сохранение повышенных концентраций опухолевых маркеров в сыворотке крови после выполнения орхфуникулэктомии позволяет заподозрить наличие метастазов. Наиболее часто при НГОЯ поражаются забрюшинные лимфатические узлы (90% случаев) и легкие.
Герминогенные опухоли яичка I стадии
Первая стадия несеминомных герминогенных опухолей яичка устанавливается больным после выполнения орхфуникулэктомии при отсутствии метастазов, по данным КТ грудной и брюшной полости, и нормализации уровня опухолевых маркеров. В настоящее время предложено три альтернативных метода лечебной тактики у больных НГОЯ I стадии.
С появлением современных методов визуализации, особенно компьютерной томографии (КТ) и определения концентрации уровня опухолевых маркеров сыворотки крови, значительно увеличилась точность диагностики I стадии НГОЯ. Исследования результатов лечения больных, которым выполнялась забрюшинная лимфаденэктомия (ЗЛАЭ), показали, что 20%-25% пациентов с клинической I стадией заболевания имеют микрометастазы в забрюшинных лимфоузлах. В дальнейшем у 10% больных этой группы отмечается появление висцеральных метастазов. Теоретически это означает, что 70% пациентов с I стадией НГОЯ могут быть излечены только орхфуникулэктомией.Использование КТ и определение уровня опухолевых маркеров дают возможность выявлять рецидивы на ранних сроках, когда опухоль имеет небольшие размеры, и применение химиотерапии (ХТ), основанной на препаратах платины, позволяет полностью излечить практически всех больных этой группы.В 1979 г. в Англии было проведено исследование нового направления в лечении больных несеминомными опухолями яичка I стадии - динамического наблюдения. В дальнейшем во всем мире были выполнены многочисленные исследования, посвященные этому вопросу, включившие более 2000 больных. Суммарные результаты были следующими: частота рецидивирования после удаления первичной опухоли при I клинической стадии НГОЯ составила 30%. Более 95% рецидивов развивалось в течение первых двух лет после орхфуникулэктомии, в среднем - через 4-13 месяцев. В большинстве работ наиболее часто прогрессирование заболевания отмечалось через 4-5 месяцев после удаления первичной опухоли.Пятьдесят процентов рецидивных опухолей локализовалось в забрюшинном пространстве, при этом в одной трети случаев не отмечалось повышения уровня опухолевых маркеров. Одна треть рецидивов развивалась в легких и медиастинальных лимфоузлах, концентрация АФП и ХГ возрастала только у 11% больных. У большинства пациентов, особенно при повышении уровня опухолевых маркеров, рецидивы диагностировались на ранних стадиях, и проведение ХТ, основанной на препаратах платины, позволило добиться прекрасных результатов. Из 2222 пациентов, включенных в исследования, 2169 (97,6%) живы без признаков заболевания. Практически все из 53 умерших больных погибли от прогрессирования опухолевого процесса.
До появления химиотерапии, основанной на препаратах платины, основным методом лечения больных НГОЯ являлась забрюшинная лимфаденэктомия (ЗЛАЭ). Наиболее серьезным недостатком этой операции является развитие ретроградной эякуляции и бесплодия. Это связано с тем, что во время лимфодиссекции пересекаются ответственные за семяизвержение постганглионарные эфферентные симпатические волокна, располагающиеся парааортально ниже уровня отхождения нижней брыжеечной артерии. В 1982 г. Narayan при I стадии НГОЯ впервые выполнил ЗЛАЭ с сохранением этих нервных стволов. При этом, увеличения частоты рецидивирования отмечено не было. В 1990 г. данные Narayan были подтверждены Richie.В настоящее время лечебно- диагностическая нервсберегающая забрюшинная лимфаденэктомия является одним из общепринятых вариантов лечения пациентов с герминогенными опухолями I стадии. Ретроперитонеальная лимфатическая ткань удаляется с учетом наиболее частой локализации метастазов в забрюшинном пространстве. При этом сохраняются симпатические волокна, обеспечивающие антеградную эякуляцию.В группе больных, не имевших метастазов в удаленных забрюшинных лимфоузлах, полное излечение с помощью хирургического метода достигается в 95% случаев. Однако у 5-10% пациентов с отрицательным результатом морфологического исследования после ЗЛАЭ развиваются рецидивы опухоли. При наличии микрометастазов в удаленных забрюшинных лимфоузлах ЗЛАЭ обеспечивает излечение 50-75% больных. В случаях рецидивирования после хирургического лечения проведение химиотерапии приводит к полному выздоровлению 97-99% пациентов.Прогрессирование заболевания после ЗЛАЭ отмечается у 5-10% пациентов. В большинстве случаев рецидивы опухоли развиваются в течение первых двух лет после операции. Чаще всего при прогрессировании опухолевого процесса у оперированных пациентов появляются метастазы в легкие. Местные рецидивы в забрюшинном пространстве развиваются крайне редко, в основном, у больных с метастатически измененными лимфоузлами.Хирургический метод лечения больных I стадией НГОЯ имеет ряд преимуществ. Современные неинвазивные методы диагностики не обладают достаточной разрешающей способностью, и в ряде случаев стадия заболевания занижается. Учитывая то, что в 90% случаев НГОЯ метастазируют в забрюшинные лимфоузлы, хирургическое удаление лимфатической ткани из забрюшинного пространства является золотым стандартом стадирования при опухолях яичка. Операция помогает достоверно подтвердить наличие или отсутствие метастазов, и избрать соответствующую тактику дальнейшего лечения. Так как выполнение ЗЛАЭ приводит в большинстве случаев к выздоровлению больных I стадией НГОЯ, необходимость проведения химиотерапии в дальнейшем отпадает. Низкая стадия заболевания позволяет, выполняя небольшой объем хирургического вмешательства, сохранять симпатические нервные волокна, ответственные за эякуляцию. Поэтому у большинства больных сохраняется способность к оплодотворению. Кроме того, операция увеличивает психологический комфорт пациента, у которого отпадает необходимость ожидать появления рецидива.
Химиотерапия при клинической и гистологической стадии НГОЯ стала применяться относительно недавно. Количество опубликованных исследований, посвященных этому вопросу, невелико. Наибольшая эффективность отмечена при применении курсов адъювантной химиотерапии по схеме (этопозид 100 мг/м2 1-5 дни, цисплатин 20 мг/м2 1-5 дни, блеомицин 15 мг 1,3,5 дни) или ЕР (этопозид 100 мг/м2 1-5 дни, цисплатин 20 мг/м2 1-5 дни). Полное излечение достигается у 97-99% больных. Вероятность развития как острых, так и хронических осложнений низка, благодаря малому количеству курсов химиотерапии.На основании изучения результатов лечения больных НГОЯ I стадии, находившихся под динамическим наблюдением, несколькими исследователями были выделены прогностические параметры для определения групп с высоким и низким риском развития рецидива. Pont считает, что с меньшей безрецидивной выживаемостью ассоциирована сосудистая инвазия. Gimmi относит к неблагоприятным прогностическим факторам наличие элементов эмбрионального рака в первичной опухоли и стадию рТ 2 и более. В работе Medical Research Council (MRC) независимыми прогностическими факторами оказались: 1) опухолевая инвазия лимфатических щелей и сосудов, 2) инвазия кровеносных сосудов, 3) элементы эмбрионального рака в опухоли яичка, 4) отсутствие элементов опухоли желточного мешка в первичной опухоли.По данным MRC (Medical Research Council), при применении ХТ с включением цисплатина, этопозида и блеомицина у пациентов с наличием трех или четырех факторов риска двухлетняя безрецидивная выживаемость составила только 42%, тогда как у больных с двумя и одним фактором риска этот показатель достигал 75% и 91% соответственно. На основании этих данных, MRC предлагает проведение химиотерапии только больным с высоким риском развития рецидивов. Большинство исследователей поддерживает эту точку зрения.
Таким образом, учитывая одинаковую эффективность существующих лечебных подходов к больным НГОЯ I стадии, выбор тактики должен определяться индивидуально. С целью снижения летальности и улучшения непосредственных результатов лечения необходимо тщательное обследование, точное стадирование и внимательное исследование гистологического строения первичной опухоли. Кроме того обязательна оценка наличия сосудистой и лимфатической инвазии, уровня опухолевых маркеров и стадии рТ. Больные НГОЯ I стадии с отсутствием факторов риска могут находиться под динамическим наблюдением, что позволяет избежать осложнений ЗЛАЭ. К этой группе относится около 1/3 пациентов, частота рецидивов у них минимальна. В группе пациентов, имеющих неблагоприятный прогноз, частота рецидивов во много раз выше. Если в первичной опухоли присутствуют элементы тератомы, наиболее вероятно прогрессирование заболевания в забрюшинном пространстве. Учитывая нечувствительность тератомы к ХТ, в этом случае показано выполнение ЗЛАЭ. Среди больных с элементами эмбрионального рака в новообразовании яичка (80%) частота рецидивов достигает 50%. При этом метастазы в ретроперитонеальном пространстве и легких развиваются с одинаковой частотой. Для этой группы пациентов оптимальный метод лечения окончательно не определен. В подобной ситуации возможно выполнение ЗЛАЭ. В ряде исследований отмечено улучшение результатов при применении ХТ.
До настоящего времени не разработано общепринятой тактики наблюдения за больными НГОЯ I стадии после орхрофуникулэктомии. Мы считаем, что контрольное обследование должно включать УЗИ органов брюшной полости и забрюшинного пространства, рентгенографию органов грудной клетки и определение уровня опухолевых маркеров ежемесячное в течение 1-го года и каждые 2 месяца в течение 2-го года. Учитывая низкую частоту рецидивирования через 2 года после орхофуникулэктомии, в дальнейшем обследование достаточно проводить 1 раз в год. Большинство исследователей предлагает выполнять КТ органов грудной, брюшной полостей и забрюшинного пространства каждые 4 месяца в течение 1-го года и каждые 4-6 месяцев в течение 2-го года после удаления опухоли яичка, а также в конце 5-го года наблюдения. Больные НГОЯ I стадии, подвергнутые ЗЛАЭ нуждаются в аналогичных контрольных обследованиях, особенно в течение первых двух лет. Учитывая низкую частоту рецидивирования через 2 года после операции, в дальнейшем обследование достаточно проводить 1 раз в год.
Герминогенные опухоли яичка II A,B стадии
Герминогенные опухоли яичка II стадии характеризуются наличием метастазов в забрюшинные лимфоузлы. При II A,B стадиях заболевания (забрюшинные лимфоузлы менее 5 см) возможно применение двух лечебных подходов, дающих одинаковый процент излечения: индукционная химиотерапия с последующей ЗЛАЭ и первичная ЗЛАЭ с адъювантной химиотерапией.
- Индукционная химиотерапия с последующей ЗЛАЭГерминогенные опухоли яичка уникально чувствительны к химиотерапевтическому лечению. C 1974 по 1976 г. было проведено первое исследование комбинации PVB (цисплатин, винбластин, блеомицин), которая использовалась при лечении 47 больных несеминомными опухолями яичка, с достижением полной регрессии опухоли у 70% пациентов. Многими исследователями было подтверждено повышение эффективности комбинации блеомицина и винбластина при добавлении цисплатина.В 1981 и 1986 г. были опубликованы сообщения о применении пятикомпонентной комбинации VAB-6 (винбластин, дактиномицин, блеомицин, циклофосфан, цисплатин) у больных несеминомными опухолями яичка. Эффективность VAB-6 оказалась достоверно выше, чем PVB (78% полных регрессий), а токсичность значительно ниже.Следующим этапом в развитии химиотерапии опухолей яичка стало появление этопозида - полусинтетического препарата, гликозидного деривата подофиллотоксина. Была доказана эффективность этопозида в лечении химиорезистентного рака яичка, применяемого в монотерапии. В эксперименте был выявлен синергизм цисплатина и этопозида, после чего была предложена схема BEP (блеомицин, этопозид, цисплатин). В рандомизированном исследовании была выявлена большая эффективность и меньшая токсичность схемы BEP по сравнению с PVB. В настоящее время комбинация BEP является стандартной химиотерапии первой линии при лечении несеминомных опухолей яичка.Эффективность химиотерапии зависит от степени распространенности опухолевого процесса. Многочисленными исследователями сравнивались эффективность и токсичность различных режимов индукционной химиотерапии при лечении несеминомных опухолей яичка с хорошим прогнозом (минимальная и умеренная степени распространения болезни). Университетом Индианы была выполнена работа, доказывающая, что проведение 3-х курсов индукционной химиотерапии по схеме BEP столь же эффективно, как и проведение 4-х. Исключение 4-го курса BEP позволило снизить токсичность. Был сделан вывод, что в качестве индукционной химиотерапии при несеминомных опухолях яичка может использоваться 3 курса ВЕР, что было подтверждено дальнейшими исследованиями тех же авторов.Многими авторами изучалось значение блеомицина в индукционной химиотерапии герминогенных опухолей яичка. Было проведено исследование, сравнивающее эффективность 3-х курсов ВЕР и 3-х курсов ЕР. Однако, попытка исключения блеомицина с целью снижения токсичности химиотерапии привела к снижению эффективности лечения. При сравнении 4 курсов ЕР и 3 курсов ВЕР была доказана их одинаковая эффективность.Таким образом, в настоящее время в качестве индукционной полихимиотерапии первой линии общепринятым считается проведение 3-х курсов BEP или 4-х курсов ЕР.В другом исследовании была доказана одинаковая эффективность 3 курсов VAB-6 и 4 курсов ЕР на этапе индукции при менее выраженной токсичности 4-х курсов ЕР. При сравнении PVB и PV (цисплатин, винбластин) не выявлено различий между непосредственными и отдаленными результатами. Однако, ни одно из проведенных исследований не позволяет с уверенностью исключить блеомицин из схем индукционной терапии при лечении герминогенных опухолей яичка.Группа с плохим прогнозом составляет от 31% (по классификации MSKCC) до 61% (по классификации EORTC) от всех больных герминогенными опухолями яичка. Результаты химиотерапевтического лечения этих пациентов остаются неудовлетворительными: эффективность составляет 40-60%. Несмотря на то, что проводятся поиски более агрессивных режимов, на данный момент наиболее эффективным остается проведение 4-х курсов ВЕР.В связи с появлением колоние- стимулирующих факторов и возможности выполнения аутотрансплантации костного мозга, стало возможно проведение высокодозной химиотерапии препаратами, обладающими гематологической токсичностью и вызывающими глубокую лейкотромбопению.Одним из вариантов повышения интенсивности индукционной терапии является сокращение интервалов между курсами химиотерапии, что предотвращает пролиферацию опухоли и развитие резистентности к противоопухолевым препаратам. Перспективное направление химиотерапии больных с плохим прогнозом - чередование разных комбинаций. Однако, небольшое количество наблюдений не позволяет сделать окончательных выводов относительно данного подхода к лечению больных диссеминированными НГОЯ.Таким образом, в настоящее время одним из методов лечения больных НГОЯ II A,В стадий является проведение трех курсов индукционной химиотерапии по схеме ВЕР или 4 - по схеме ЕР. Резидуальная опухоль более 1 см после ХТ подлежит хирургическому удалению. Первичная химиотерапия позволяет достичь полной ремиссии у 87% пациентов при II A и у 67% - при II В стадиях, что позволяет отказаться от дальнейшего хирургического лечения. К недостаткам этой лечебной тактики можно отнести проведение ХТ больным, которые в ней не нуждаются. К этой группе пациентов относятся больные тератомой, являющейся нечувствительной к химиотерапии, а также больные, у которых произошло завышение стадирования. Проведение большего числа курсов обуславливает большую токсичность, чем при проведении ХТ после ЗЛАЭ. Кроме того, фиброз ретроперитонеальных тканей после ХТ затрудняет выполнение ЗЛАЭ, увеличивает продолжительность операции и частоту послеоперационных осложнений.
- ЗЛАЭ с последующей ХТВторым возможным подходом при лечении НГОЯ II А,В стадий является выполнение ЗЛАЭ с последующей ХТ. Удаление забрюшинных лимфоузлов носит лечебно-диагностический характер. Около 50% пациентов с II А и В стадиями может быть излечено только с помощью ЗЛАЭ, не подвергаясь токсическому воздействию адъювантной химиотерапии. Однако, при использовании только хирургического метода прогрессирование заболевания отмечается у 25% больных при II А и у 50% - при II В стадиях. Это диктует необходимость проведения 2 курсов адъювантной химиотерапии по схеме ВЕР. Применение данной тактики обеспечивает выздоровление 99% больных. Местные рецидивы развиваются в 3% случаев, и требуют проведения 3-4 курсов химиотерапии.Помимо высокого лечебного эффекта, преимуществом ЗЛАЭ является точное стадирование опухолевого процесса. Это дает возможность избежать проведения химиотерапии при ложноположительных результатах КТ. К недостаткам относится вероятность развития послеоперационных осложнений, в том числе - ретроградной эякуляции.
Герминогенные опухоли яичка IIC-III стадии
Лечение больных несеминомными герминогенными опухолями яичка II С и III стадии (забрюшинные метастазы более 5 см) всегда начинают с индукционной химиотерапии (3 курса ХТ по схеме ВЕР или 4 - по схеме ЕР).
У 20-30% больных индукционная химиотерапия не приводит к излечению. К этой группе относятся больные, у которых не была получена полная регрессия, и пациенты с рецидивами заболевания после исчезновения всех признаков болезни. В качестве второй линии химиотерапии эффективны этопозид (эффективность - 33%, полный эффект - 10% и ифосфамид) (эффективность 23%), применяемые в режиме монохимиотерапии; комбинации ЕР (полная регрессия 42%), PEI (ифосфамид, цисплатин, этопозид; полная регрессия - 33%), VeIP (цисплатин, винбластин, ифосфамид; полная регрессия 52%). У больных с первичной резистентностью к цисплатину и вторым рецидивом предпочтительнее использовать высокодозную химиотерапию с последующей аутотрансплантацией костного мозга.
После проведенного лечения у ряда больных отмечается развитие осложнений таких, как сердечно-сосудистые заболевания, возникновение других видов опухолей, периферическая нейропатия, гематологические осложнения и снижение фертильности.
Смертность при проведении стандартной индукционной химиотерапии составляет 6-13%, а при высокодозной достигает 40%. что заставляет проводить дальнейшие поиски новых схем и оптимальных режимов.
Несмотря на чрезвычайно высокую эффективность химиотерапевтических комбинаций с включением цисплатина в лечении герминогенных опухолей яичка, у 15-30% больных отмечается неполная регрессия опухоли. Поэтому хирургическое удаление остаточных опухолевых масс после проведения индукционной химиотерапии является важным этапом лечения.
При неполном эффекте ХТ пациентам с рентгенологически определяемыми резидуальными опухолевыми массами выполняется ЗЛАЭ. Больным, у которых гистологически в удаленных забрюшинных лимфоузлах выявлена герминогенная опухоль, показано проведение адъювантной ХТ.
Противопоказанием к хирургическому лечению служит бурное прогрессирование на этапе индукции у больных с поражением забрюшинных лимфоузлов и метастазами другой локализации, а также сохранение положительных опухолевых маркеров.
У больных с положительными маркерами после индукционной ХТ лечебная тактика должна определяться строго индивидуально. Обычно этой категории больных проводится ХТ второй линии. Однако при неэффективности химиотерапевтического лечения второй линии, или невозможности его продолжения маркер-положительным больным может быть произведена ЗЛАЭ.
После индукционного лечения забрюшинные метастазы могут замещаться фиброзно-некротическими тканями. Обычно, при гистологическом исследовании удаленных метастазов фиброзно-некротические массы выявляются в 40%, тератома - в 40%, жизнеспособная герминогенная опухоль - в 20% случаев. Достоверное предсказание фиброза в остаточных забрюшинных массах позволило бы воздержаться от необоснованного хирургического вмешательства у 34%-40% больных диссеминированными НГОЯ после индукционной ХТ. На данный момент на основании ретроспективных исследований четких критериев предсказания фиброза и некроза не выявлено. Поэтому всем пациентам, имеющим рентгенологически определяемые забрюшинные метастазы после проведения индукционного лечения, показана ЗЛАЭ.
Оптимальным хирургическим доступом для выполнения ЗЛАЭ является срединная лапаротомия. Удаляя ретроперитонеальную лимфатическую ткань, необходимо стараться радикально удалить опухолевые массы. В ряде случаев с целью полного удаления опухоли обоснованы резекция аорты с ее последующим протезированием, резекция нижней полой вены, нефрэктомия.
Особенно важно радикальное хирургическое удаление тератомы. Заподозрить наличие элементов тератомы в опухоли можно при увеличении ее размеров на фоне проведения ХТ при снижении опухолевых маркеров (синдром растущей тератомы). Тератома является химиорезистентной опухолью, имеющей тенденцию к инфильтративному росту и способностью малигнизироваться. Это обуславливает жизненную необходимость полного удаления тератомы во время забрюшинной лимфаденэктомии.
Выполнение ЗЛАЭ после индукционной химиотерапии сопряжено с большими техническими сложностями, обусловленными фиброзом ретроперитонеальных тканей, интимной связью опухолево- измененных лимфатических узлов с магистральными сосудами, почечной ножкой, мочеточником. Совокупность этих факторов затрудняет ориентацию в забрюшинном пространстве, вызывает трудности при полном удалении метастазов и обуславливает интраоперационные осложнения.
Большинство осложнений возникает у больных с большим объемом опухолевого процесса в забрюшинном пространстве. Самым частым интраоперационным осложнением является повреждение сосудистых структур: аорты, нижней полой вены, почечной артерии, поясничных артерий. Нередко во время забрюшинной лимфаденэктомии повреждается мочеточник.
Наиболее серьезным осложнением после ЗЛАЭ, которое может привести к летальному исходу, является дыхательный дистресс- синдром, ассоциированный с блеомициновой токсичностью. В раннем послеоперационном периоде отмечаются осложнения, обычно встречающиеся после операций на брюшной полости (кишечная непроходимость, перитонит, эвентерация, нагноения раны). Послеоперационная летальность в группе пациентов с I-II A, B стадиями составляет 1%, II C - III - 3%.
Комбинированное лечение приводит к полному излечению 75% больных несеминомными опухолями яичка IIC-III стадий. Благоприятными прогностическими факторами являются: полный эффект комбинированного лечения, радикальный характер хирургического вмешательства, эффективность индукционной ХТ более 90%, отрицательные опухолевые маркеры перед выполнением ЗЛАЭ, наличие некроза и зрелой тератомы в удаленных забрюшинных массах. В 10-30% случаев у больных несеминомными герминогенными опухолями яичка после комбинированного лечения развиваются местные рецидивы заболевания в забрюшинном пространстве. Следует отдельно отметить, что при тщательном выполнении всех этапов хирургического вмешательства частота рецидивов снижается на 20%. С целью их своевременного выявления всем пациентам этой группы показано тщательное динамическое наблюдение. Прогрессирование заболевания после комбинированного лечения чаще развивается у пациентов с положительными опухолевыми маркерами после проведения индукционной ХТ и жизнеспособными опухолевыми клетками в удаленных забрюшинных метастазах.
Герминогенные опухоли яичка IV стадии
Тактика лечения больных IV стадией с висцеральными метастазами различных локализаций принципиально не отличается от таковой при III стадии заболевания. При сохранении солитарных и единичных опухолевых очагов после индукционного лечения рекомендуется агрессивный хирургический подход. Наиболее часто после ЗЛАЭ производится резекция легких разных объемов с целью удаления оставшихся легочных метастазов и медиастинальная лимфаденэктомия. При наличии нескольких зон метастатического поражения возможно выполнение симультанных операций. Удаление всех опухолевых очагов увеличивает выживаемость данной категории пациентов. Хирургическое лечение позволяет добиться полного выздоровления даже у больных с метастазами в головной мозг в 39% случаев.
Сохранение фертильности больными, получающими лечение по поводу опухолей яичка, является одним из существенных вопросов, обсуждаемых в рамках этой проблемы. У больных герминогенными опухолями яичка до начала лечения с высокой частотой выявляется олиго- и азооспермия. У 30% пациентов отмечается повышение уровня ФСГ, обуславливающего длительные изменения сперматогенеза. Если азооспермия сочетается с высокой концентрацией ФСГ, риск полной потери фертильности очень высок и не зависит от дальнейшего лечения. Кроме того, повышение уровня ХГ при опухолях яичка вызывает увеличение выработки эстрадиола, который сильно подавляет сперматогенез.
Все этапы проводимого лечение оказывают неблагоприятное влияние на сперматогенез. После орхфуникулэктомии частота азооспермии составляет10-15%, а олигоспермии - 50%. У большинства больных наблюдается азоо- и олигоспенрмия в течение 10-14 месяцев после проведения стандартной ХТ. При применении высоких доз ифосфамида и/или цисплатина риск стойкой длительной азоо- и олигоспенрмии возрастает. Использование современных методов экранирования при проведении облучения больным семиномой не позволяет полностью избежать негативного влияния ЛТ на сперматогенез. При облучении пахово- подвздошных лимфоузлов доза облучения оставшегося яичка составляет 50 мГр. Сперматогенез восстанавливается в течение 2-3 лет. При облучении забрюшинных лимфоузлов доза облучения оставшегося яичка составляет 20 мГр. Сперматогенез восстанавливается в течение 1 года. Во время выполнения стандартной забрюшинной лимфаденэктомии пересекаются симпатические нервные волокна, ответственные за нормальное семяизвержение. При их повреждении развивается ретроградная эякуляция. Однако выполнение нервосберегающих ЗЛАЭ позволяет сохранить семяизвержение у 70-90% больных. Фертильность резко снижается при комбинированном лечении: сочетании химиотерапии, облучения и стандартной ЗЛАЭ.
Однако наиболее значимыми факторами, ассоциированными с сохранением фертильности, являются не вид и продолжительность ХТ и ЛТ, а молодой возраст и низкий уровень ФСГ.
Подавляющее число больных опухолями яичка восстанавливают фертильность в ближайшие годы после окончания лечения и способны стать отцом самостоятельно или путем искусственного оплодотворения. У детей больных опухолями яичка не отмечено увеличения частоты пороков развития. Во многом проблемы фертильности у больных опухолями яичка помогает решить банк спермы.
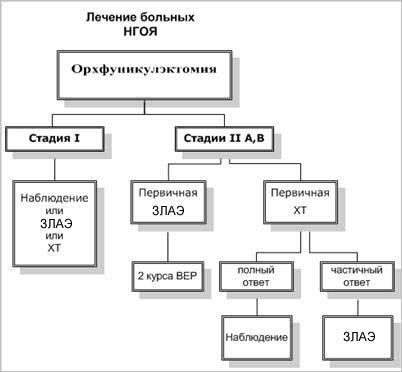
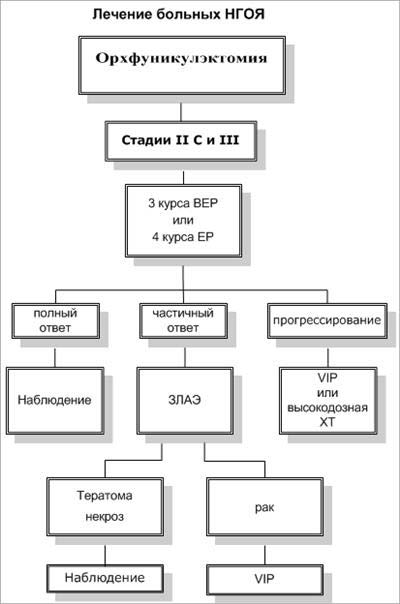
Схема 1 (продолжение).
ЗЛАЭ - забрюшинная лимфаденэктомия
ЕР - этопозид, цисплатин
ВЕР - блеомицин, этопозид, цисплатин
VIP - винбластин, ифосфамид, цисплатин

