 Рак костей представляет собой довольно редкий вид онкологической патологии, о наличии которой больной не подозревает длительное время. Постепенно нарастающие болевые ощущения, приводят пациента к врачу далеко не сразу. Причины заболевания ни с чем конкретным специалисты онкологи не связывают, опухоль кости рассматривают как собирательный термин для обозначения доброкачественных и злокачественных новообразований.
Рак костей представляет собой довольно редкий вид онкологической патологии, о наличии которой больной не подозревает длительное время. Постепенно нарастающие болевые ощущения, приводят пациента к врачу далеко не сразу. Причины заболевания ни с чем конкретным специалисты онкологи не связывают, опухоль кости рассматривают как собирательный термин для обозначения доброкачественных и злокачественных новообразований.
Клиническая картина развивается медленно, в ходе течения заболевания выявляется 3 главных симптома:
- боль в зоне поражения;
- наличие злокачественного новообразования;
- нарушение функции поврежденной конечности.
Боль следует оценивать как ранний признак болезни на первых стадиях, когда она еще не такая сильная, периодически возникает и также незаметно пропадает, нередко усиливается ночью. Только с течением времени отмечается точная локализация болевых ощущений, они не проходит ни в состоянии покоя, ни после сна и отдыха, боль чувствуется всегда. Далее становится заметной деформация контуров кости в зоне возникновения опухоли, новообразование прощупывается при пальпации, возможен отек мягких тканей. К сожалению, это уже прогрессирующее заболевание, оно распространилось на соседние ткани, кожный покров истончается, становится бледным, под ним просвечивается рисунок вен. Замечено, если опухоль располагается по краям трубчатых костей — быстро возникают трудности при движении, сопровождающиеся атрофией мышц, в отличие от опухоли, расположенной в средней части кости, постепенно нарушающей функционирование конечностей.
 Рак кости — довольно редкое заболевание, встречающееся в 1% всех случаев злокачественных опухолей. но беда в том, что в кость довольно часто метастазируют опухоли других органов, в таком случае речь идет о вторичной опухоли, что нередко встречается у молодых мужчин, 20-30 лет. Длительно не проходящую боль начинают лечить анальгетиками и народными средствами, но она не снимается, заболевание прогрессирует, пальпация становится болезненной и невозможной, метастазы проявляются в других органах.
Рак кости — довольно редкое заболевание, встречающееся в 1% всех случаев злокачественных опухолей. но беда в том, что в кость довольно часто метастазируют опухоли других органов, в таком случае речь идет о вторичной опухоли, что нередко встречается у молодых мужчин, 20-30 лет. Длительно не проходящую боль начинают лечить анальгетиками и народными средствами, но она не снимается, заболевание прогрессирует, пальпация становится болезненной и невозможной, метастазы проявляются в других органах.
Диагностика рака кости базируется на четком описании картины болезни с полным клинико-инструментальным обследованием. Рентгенологический метод, МРТ и КТ помогают тщательно исследовать пораженную кость, собственно опухоль и соседние мягкие ткани.
Новейшие методы лечения лучевой прицельной терапией имеют минимум побочных эффектов по сравнению с химиотерапией, которую традиционно применяют как до проведения хирургического вмешательства, так и после него, дозировку лекарственных средств определяет специалист онколог. При радиолечении проводят уничтожение клеток опухоли рентгеновскими лучами в малых дозах согласно назначениям врача радиолога. Оперативное вмешательство — это удаление опухоли, близлежащих тканей, нервов и кровеносных сосудов. Прогноз для жизни в случае своевременного и корректного лечения с использованием современных технологий — благоприятный.
-
Ежедневно в организме каждого из нас образуются опухолевые клетки. Они отличаются от обычных не только формой и размером, но и способностью к бесконтрольному делению и проникновению в другие ткани. Клетки становятся злокачественными из-за поломок или мутации в их ДНК. Некоторые генетические дефекты или инфекции могут увеличить риск развития рака. Кроме того, на частоту мутаций и образования раковых клеток влияют канцерогенные факторы: загрязнение воздуха, табачные смолы, суррогаты алкоголя, употребление жирной и жареной пищи, нарушение уровней половых гормонов, ожирение и многое другое.
Как получается, что опухолевые клетки образуются у всех людей, а болезнь развивается лишь у некоторых? В подавляющем большинстве случаев наша иммунная система способна обнаружить и устранить клетки с поврежденной ДНК. Опухоль формируется, если клетка сумела скрыть изменения ДНК и получила возможность расти и неограниченно делиться.
В чем отличие доброкачественных и злокачественных новообразований?
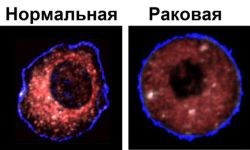 Доброкачественные новообразования растут в пределах одной ткани и не склонны к метастазированию. Злокачественные опухоли более агрессивны и способны отделяться от основной массы образования, проникать в другие ткани и формировать независимые очаги. Способность к метастазированию — ключевое отличие злокачественных опухолей.
Доброкачественные новообразования растут в пределах одной ткани и не склонны к метастазированию. Злокачественные опухоли более агрессивны и способны отделяться от основной массы образования, проникать в другие ткани и формировать независимые очаги. Способность к метастазированию — ключевое отличие злокачественных опухолей.Опухолевые клетки обычно метастазируют в другие ткани через лимфатическую систему или кровь. Чаще всего вторичные опухоли, или метастазы, обнаруживают в легких, костях, печени, головном мозге. Опухоли некоторых органов имеют специфические пути метастазирования, что связано с особенностями крово- и лимфооттока от самого органа. Так, при раке молочной железы можно встретить метастазы в яичники или вторую железу, а при раке желудка — вторичное поражение пупка. Метастаз нельзя воспринимать как отдельную опухоль, он подлежит лечению по тем же схемам терапии, которые применимы для первичной опухоли. Метастазы рака молочной железы в печень или легкие будут лучше всего реагировать на схемы терапии рака молочной железы. Скорости роста и развития метастазов напрямую зависят от особенностей первичной опухоли. Метастазы рака желудка в легких растут довольно быстро и плохо реагируют на лекарства, а легочные метастазы рака кишечника развиваются достаточно медленно и даже могут быть удалены хирургическим путем.
В настоящее время лишь редкие типы метастатического рака поддаются полному излечению, при большинстве из них врачам удается лишь на некоторое время продлить жизнь больного.
Какие факторы провоцируют развитие рака?
Факторы, которые провоцируют развитие рака, называют канцерогенными. Мы уже публиковали перечень основных факторов которые способствуют повреждению ДНК и повышают риск развития опухоли.
Некоторые гены контролируют жизненный цикл клеток: их рост, функции, деление и смерть. Если эти гены повреждены, то баланс между нормальным ростом и гибелью клеток нарушается. Именно из-за таких генетических поломок женщины с мутацией в генах BRCA1 и BRCA2 имеют и повышенные риски развития рака молочных желез и яичников в молодом возрасте. Не так давно врачи стали предлагать таким женщинам профилактическое удаление органов. Самый известный случай, вызвавший бурю дискуссий в интернете — Анджелина Джоли. удалившая яичники. В России пока профилактическое удаление здоровых органов запрещено и женщинам с такими мутациями рекомендуется регулярное наблюдение у онколога.
Значительно выше риск развития злокачественных новообразований у людей, которые ранее перенесли химиотерапию или лучевое лечение злокачественной опухоли или принимают иммунодепрессанты.
Какие виды злокачественных опухолей известны?
Злокачественная опухоль может возникнуть в любой части тела. Обычно злокачественные заболевания делят на солидные — опухоли из твердых тканей (например, раки молочной железы, легкого или простаты) или гематологические (опухоли крови). Так же опухоли разделяют в зависимости от типа ткани, в которой она возникла:
- Карциномы — опухоли, которые происходят из эпителиальных тканей. Они составляют 80-90%% всех случаев злокачественных заболеваний. К ним относятся классические опухоли грудных, предстательной и других видов желез, раки легких, толстой кишки, желудка, кожи, языка, гортаноглотки, мочевого пузыря и многие другие;
- Саркомы — опухоли из соединительной ткани, чаще всего возникают из костей, хрящей, жировой ткани, кровеносных сосудов и мышц;
- Миеломы происходят из плазматических клеток костного мозга;
- Лейкозы — опухоли красного костного мозга;
- Лимфомы — опухоли из клеток иммунной системы;
- Глиомы — опухоли головного и спинного мозга.
- Меланомы — опухоли из пигментных клеток кожи — меланоцитов.
Кроме того встречаются и смешанные виды опухолей, которые содержат клетки нескольких типов тканей.
Каковы основные симптомы рака?
Известно более 100 различных видов злокачественных опухолей. Каждая из них имеет свои симптомы и признаки. Ученые, обеспокоенные поздним выявлением рака составили список из 10 основных симптомов этого заболевания. Однако каждый человек уникален, и грозные симптомы возникают в разное время и в разном порядке. Признаки болезни зависят от размера и местоположения опухоли, а также наличия или отсутствия метастазов.
Если у вас появились какие-то непонятные симптомы, не стоит пугаться, но и откладывать обращение к врачу не стоит. Они могут быть проявлением любой патологии: анемии, гипотиреоза или другого соматического заболевания. Не стоит заниматься самодиагностикой, так как большая часть онкомаркеров неэффективна при первичном выявлении опухолей, при выборе этого пути очень высок риск потратить впустую деньги и время. Помните, что раннее выявление злокачественных образований позволяет вылечить его полностью или продлить жизнь на годы.
От чего зависит эффективность лечения в онкологии?
 В первую очередь, от ранней диагностики. В большинстве случаев рак, обнаруженный на ранней стадии, излечим. В европейских странах и США существуют обязательные программы скрининга: скрининг на рак груди для женщин старше 40 лет, анализ крови на ПСА для раннего выявления рака простаты у мужчин с 50 лет, колоноскопия — обследование толстого кишечника с 50 лет — и ряд других исследований, позволяющих обнаружить онкологические заболевания на ранней стадии. В нашей стране система ранней диагностики практически отсутствует, поэтому необходимо заботиться о своем здоровье и проходить необходимые исследования по собственной инициативе.
В первую очередь, от ранней диагностики. В большинстве случаев рак, обнаруженный на ранней стадии, излечим. В европейских странах и США существуют обязательные программы скрининга: скрининг на рак груди для женщин старше 40 лет, анализ крови на ПСА для раннего выявления рака простаты у мужчин с 50 лет, колоноскопия — обследование толстого кишечника с 50 лет — и ряд других исследований, позволяющих обнаружить онкологические заболевания на ранней стадии. В нашей стране система ранней диагностики практически отсутствует, поэтому необходимо заботиться о своем здоровье и проходить необходимые исследования по собственной инициативе.Второе — это развитие медицинских технологий: таргетной терапии, роботизированной хирургии, лучевой терапии и ядерной медицины, в частности, ПЭТ-КТ диагностики.
ПЭК-КТ (позитронно-эмиссионная томография, совмещенная с компьютерной томографией) — современный и эффективный метод, который используется врачами-онкологами во всем мире для оценки стадии заболевания и контроля эффективности лечения при большинстве наиболее распространенных онкологических заболеваний, таких как рак легкого, рак молочной железы, рак желудка, меланома и многих других.
В отличие от привычных КТ и МРТ, метод визуализирует не только органы человека, но и изменения, происходящие на клеточном уровне. То есть опухоль еще не видна при проведении УЗИ или обычной компьютерной томографии, но на ПЭТ-КТ уже виден участок повышенного потребления глюкозы, характерный для злокачественного процесса.
«Весь мир приходит к тому, что называется tailored approach — индивидуализированный подход к лечению онкологических заболеваний, — рассказывает специалист по диагностике онкологических заболеваний Европейского медицинского центра профессор радиологии Евгений Либсон. — Сегодня мы стремимся получить полный генетический профиль опухоли и, как в случае с антибиотиками, определить, к какому препарату опухоль будет чувствительна, а к какому — нет. ПЭТ-КТ диагностика позволяет оценить результаты и принять решение о дальнейшей тактике лечения. Если раньше мы проводили шесть курсов химиотерапии, а потом обследовали пациента, то сегодня мы можем провести ПЭТ-КТ уже через месяц и увидеть, действует ли препарат или его нужно заменить».
 ПЭТ-КТ диагностика рекомендована в международных стандартах оказания помощи при целом ряде онкологических заболеваний. К сожалению, в России такие стандарты пока отсутствуют. Часто пациенты узнают о том, что нужна была ПЭТ-диагностика, уже после того, как потеряно много времени и средств на неэффективное лечение.
ПЭТ-КТ диагностика рекомендована в международных стандартах оказания помощи при целом ряде онкологических заболеваний. К сожалению, в России такие стандарты пока отсутствуют. Часто пациенты узнают о том, что нужна была ПЭТ-диагностика, уже после того, как потеряно много времени и средств на неэффективное лечение.Потребность в ПЭТ по мировым стандартам составляет примерно 1 сканер на 1,5 млн. человек. В России работают около 10 центров, что составляет примерно 10% от потребности.
Почему так мало? Проблема не только в высокой стоимости томографов, но и в нехватке квалифицированных специалистов, имеющих опыт проведения исследований и интерпретации результатов. Подготовка врачей радиоизотопной диагностики проводится на единственной кафедре в России — на базе Российской медицинской академии последипломного образования (РМАПО). Это курсы профессиональной переподготовки — врач, имеющий сертификат рентгенолога или онколога, становится врачом радионуклидной диагностики за 4 месяца. При этом кафедра не имеет возможности обучить врачей непосредственно работе на ПЭТ, так как не имеет соответствующего оборудования. Поэтому специалистов, способных проводить ПЭТ исследования и оценивать результаты, приходится готовить за рубежом.
Не менее важно для ПЭТ-диагностики качество радиофармпрепаратов (РФП), которые используются в процессе исследования. В производстве РФП принимают участие несколько специалистов: физики, радиохимики, которые непосредственно синтезируют препарат, химики-аналитики, которые проводят контроль качества.
 «Чтобы обеспечить пациентам в Москве ПЭТ-КТ диагностику на самом высоком уровне и избавить их от необходимости выезжать за рубеж, в центре была создана собственная лаборатория по производству препаратов для ПЭТ с соблюдением международных стандартов GMP, — рассказывает заведующий отделением радионуклидной диагностики Европейского медицинского центра Максим Смолярчук. — Врачи, радиохимики и физики прошли обучение за рубежом — в Германии, Швейцарии, Израиле, США. С нашими пациентами работают онколог из США Юлия Мандельблат, хирург-маммолог из Ирландии Искра Даскалова, лучевой терапевт из Израиля Нидаль Салим, уролог из Франции Пьер Моно и другие зарубежные специалисты. Это эксперты международных ассоциаций и сообществ, участники научных конференций и конгрессов. Соответственно, требования к качеству диагностических исследований в EMC очень высокие. Работая по протоколам Европейской ассоциации ядерной медицины, мы можем быть уверены, что данные пациента будут приняты в любой российской и зарубежной клинике. Кроме того, интерпретация результатов исследования всегда проводится двумя врачами, что исключает возможность ошибки».
«Чтобы обеспечить пациентам в Москве ПЭТ-КТ диагностику на самом высоком уровне и избавить их от необходимости выезжать за рубеж, в центре была создана собственная лаборатория по производству препаратов для ПЭТ с соблюдением международных стандартов GMP, — рассказывает заведующий отделением радионуклидной диагностики Европейского медицинского центра Максим Смолярчук. — Врачи, радиохимики и физики прошли обучение за рубежом — в Германии, Швейцарии, Израиле, США. С нашими пациентами работают онколог из США Юлия Мандельблат, хирург-маммолог из Ирландии Искра Даскалова, лучевой терапевт из Израиля Нидаль Салим, уролог из Франции Пьер Моно и другие зарубежные специалисты. Это эксперты международных ассоциаций и сообществ, участники научных конференций и конгрессов. Соответственно, требования к качеству диагностических исследований в EMC очень высокие. Работая по протоколам Европейской ассоциации ядерной медицины, мы можем быть уверены, что данные пациента будут приняты в любой российской и зарубежной клинике. Кроме того, интерпретация результатов исследования всегда проводится двумя врачами, что исключает возможность ошибки».ПЭТ-КТ-диагностика — это высокотехнологичная область медицины, требующая невероятных человеческих и материально-технических ресурсов, но только такие технологии позволят человечеству в итоге победить рак. И в России такие технологии становятся доступнее с каждым годом.
 Рак — злокачественное новообразование, развивающееся вследствие неконтролируемого и беспорядочного клеточного деления и вызывающее появление опухоли в ткани или органе. Опухоль имеет особенности своей локализации, гистологической структуры, роста и распространенности. Раковые клетки могут перемещаться (метастазировать) в другие ткани и органы посредством кровотока или лимфатической системы. Развитие рака может быть связано с процессом старения. Чрезвычайно важно своевременно выявить развитие этой патологии: на сегодняшний день многие виды рака поддаются лечению при условии их диагностирования на ранней стадии развития.
Рак — злокачественное новообразование, развивающееся вследствие неконтролируемого и беспорядочного клеточного деления и вызывающее появление опухоли в ткани или органе. Опухоль имеет особенности своей локализации, гистологической структуры, роста и распространенности. Раковые клетки могут перемещаться (метастазировать) в другие ткани и органы посредством кровотока или лимфатической системы. Развитие рака может быть связано с процессом старения. Чрезвычайно важно своевременно выявить развитие этой патологии: на сегодняшний день многие виды рака поддаются лечению при условии их диагностирования на ранней стадии развития.Не всегда легко установить причину развития онкологии, но существуют подтвержденные мнения о связи появления рака с нарушениями генетического характера, неправильным рационом, табакокурением, алкоголизмом и влиянием радиации и химикатов. Раковые образования способствуют истощению, анемии. гибели пораженных структур и заражению соседних. Чтобы обезопасить свое здоровье, не поленитесь обратиться к онкологу при подозрительных симптомах, проходите ежегодно диспансерное обследование. Тесты на наличие белков-онкогенов — один из простых и доступных способов диагностики.
Первые симптомы рака
Говоря о раке, важно помнить, что это заболевание способно долгое время развиваться бессимптомно. Большое внимание стоит обратить на появление:
- беспричинной потери веса;
- отсутствия аппетита;
- постоянной усталости;
- продолжительной высокой температуры тела;
- стабильных болевых ощущений;
- увеличенных лимфоузлов;
- нарушений работы кишечника и мочевого пузыря;
- подолгу не проходящих кровоточащих язв;
- крови в выделениях;
- постоянного кашля и хриплости голоса.
Чтобы выявить онкологию на ранней стадии, необходимо пройти диспансерное обследование, которое спланирует ваш лечащий врач.
Признаки рака у женщин
Среди онкологических заболеваний у женщин наиболее распространен рак придатков, шейки матки и молочной железы. К основным признакам развития рака у женщин относят:
- кровотечения после менопаузы (после прекращения появления менструаций);
- кровотечения между менструациями и продолжительные болезненные менструации (до 12 дней);
- кровянистые выделения после полового акта;
- выделения водянистого характера, возможно с сукровицей;
- изменения состояния груди или соска: появление уплотнений, сосудистых сеток, «апельсиновой корки» и пигментных пятен, выделения из соска и др.
- общее состояние дискомфорта в области половых органов: зуд и раздражение кожи.
Диагностика рака не так сложна, как кажется. Обезопасьте свое здоровье и проходите обследование у гинеколога хотя бы раз в год!
Симптомы раковых заболеваний у мужчин
 Самый распространенный вид онкологического заболевания у мужчин — рак простаты. Его основной симптом — изменения в мочеиспускании (цвет мочи, например). Кроме общих симптомов, для мужских онкологий характерны:
Самый распространенный вид онкологического заболевания у мужчин — рак простаты. Его основной симптом — изменения в мочеиспускании (цвет мочи, например). Кроме общих симптомов, для мужских онкологий характерны:- уплотнения в груди, втянутый сосок, шелушение соска и выделения из него;
- болевые ощущения разного рода;
- изменения размера яичек, появление уплотнений, припухлости и чувства тяжести;
- кровянистые выделения в мокроте, кале или моче.
Детская онкология
Наиболее распространены в детском возрасте следующие виды рака: лейкоз. рак головного мозга, лимфоузлов (лимфогранулематоз, лимфосаркома), почек (нейробластома) и костей (остеогенная саркома, опухоль Юинга). В детском возрасте мальчики заболевают раком чаще девочек. Наиболее яркими внешними признаками рака у детей являются бледная кожа, потеря аппетита и худоба, капризность, быстрая утомляемость и апатия.
 Благодаря собственному противоопухолевому иммунитету, и в первую очередь цитокинам, человечество до сих пор не вымерло от рака. Онкоиммунология и ее важнейший раздел Цитокинотерапия известны не один десяток лет, но только сейчас появилась возможность эффективно использовать этот метод благодаря последним мировым открытиям и созданным на их основе генно-инженерным противораковым препаратам. Разработки и исследования активно продолжаются, но кое-что стало доступным уже сегодня. У больных раком появился реальный шанс.
Благодаря собственному противоопухолевому иммунитету, и в первую очередь цитокинам, человечество до сих пор не вымерло от рака. Онкоиммунология и ее важнейший раздел Цитокинотерапия известны не один десяток лет, но только сейчас появилась возможность эффективно использовать этот метод благодаря последним мировым открытиям и созданным на их основе генно-инженерным противораковым препаратам. Разработки и исследования активно продолжаются, но кое-что стало доступным уже сегодня. У больных раком появился реальный шанс.Цитокины – это специфические белки, синтезируемые клетками крови, иммунной и других систем организма человека, цель которых обеспечить передачу межклеточных регулирующих сигналов и прямо через рецепторы воздействовать на клетки. Цитокиновая регуляция имеет важное значение для сохранения гомеостаза (постоянства и саморегуляции) организма в норме и при патологии.
Основные действия современной цитокинотерапии опухолей:
- непосредственное противоопухолевое и антиметастатическое действие
- профилактика рецидивов и метастазов опухоли
- синергичный противоопухолевый эффект в комбинации с химиопрепаратами
- снижение побочных эффектов традиционной противоопухолевой химиотерапии (угнетения кроветворения, иммуносупрессии), коррекция общетоксических осложнений
- профилактика и лечение сопутствующих инфекционных осложнений
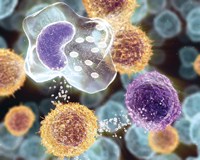 Цитокинотерапия применяется как в монорежиме, так и в комбинации с химиотерапией, лучевой терапией.
Цитокинотерапия применяется как в монорежиме, так и в комбинации с химиотерапией, лучевой терапией.Цитокинотерапия (РЕФНОТ ® и ИНГАРОН ® ) . начатая за неделю до химиотерапии, предотвратит развитие лейкопении и тромбоцитопении, уменьшит токсические явления, а продолженная после, активирует противоинфекционный иммунитет и защитит пациента от развития инфекций.
Комбинированная цитокинотерапия (РЕФНОТ ® и ИНГАРОН ® ) увеличивает эффективность химиопрепаратов . в том числе, против опухолевых клеток слабо или совсем не чувствительных к ним, ликвидируя эту резистентность . Это позволяет рассматривать РЕФНОТ ® и ИНГАРОН ® и как модификаторы противоопухолевого действия химических цитостатиков в случаях множественной лекарственной устойчивости опухолевых клеток.
Препарат ИНГАРОН ® содержит уникальный человеческий цитокин Интерферон-гамма. который в организме человека синтезируется активированными клетками иммунной системы и взаимодействует со своим специфическим рецептором на поверхности многих клеток, оказывая противоопухолевое и противовирусное действие.
Препарат ИНГАРОН ® (ИФН-гамма) зарегистрирован в 2005 г. и разрешен для лечения онкологических заболеваний человека.
Что ИФН-гамма делает в организме человека:
- Ингибирует (останавливает) репликацию вирусных РНК и ДНК в клетках.
- Ингибирует размножение внутриклеточных патогенов (вирусов, бактерий, грибков и пр.).
- Усиливает фагоцитарную активность макрофагов (завершенный фагоцитоз).
- Усиливает активность естественных киллерных клеток.
- Восстанавливает нормальный фенотип (дифференцировку) трансформированных (злокачественных) клеток.
- Ингибирует пролиферацию (замедляет или останавливает митотический цикл) опухолевых клеток.
- Вызывает программируемую клеточную смерть (апоптоз) некоторых типов опухолевых клеток.
- Ингибирует ангиогенез (образование опухолевых сосудов).
- В целом ингибирует рост опухолей.
- Снижает уровень липопротеинов, нормализует артериальное давление.
 Таким образом, противоопухолевое действие ИФН-гамма обусловлено комбинацией его иммуномодулирующей активности, прямого антипролиферативного действия на опухолевые клетки и подавления ангиогенеза.
Таким образом, противоопухолевое действие ИФН-гамма обусловлено комбинацией его иммуномодулирующей активности, прямого антипролиферативного действия на опухолевые клетки и подавления ангиогенеза.Другой цитокин человека - фактор некроза опухолей (ФНО) был обнаружен учеными в 1975 г. С 1984 г.рекомбинантный ФНО был передан в клинические исследования, которые через 3 года были приостановлены из-за высокой токсичности и низкой эффективности при системном введении ФНО.
Во всём мире учёные проводили и продолжают поиск производных (мутантных) молекул ФНО со сниженной системной токсичностью. В России в 1990 г. был создан рекомбинантный препарат РЕФНОТ ® . полученный путем слияния генов Фактора Некроза Опухолей и Тимозина-альфа1 (ФНО-Т), который стал иметь низкую системную токсичность . но при этом сохранил противоопухолевую эффективность природного ФНО и приобрёл новые сильные иммуностимулирующие свойства (ФНО-Т имеет в >100 раз меньшую общую токсичность, чем ФНО, что подтверждено клиническими испытаниями в РОНЦ им. Н. Н. Блохина (г. Москва) и НИИ Онкологии им. Н. Н. Петрова (г. Санкт-Петербург)).
Препарат Рекомбинантного Фактора Некроза Опухолей-Тимозина-a1 (РЕФНОТ®) прошёл три полных фазы клинических испытаний, зарегистрирован 27 марта 2009 г. и официально разрешен для лечения злокачественных опухолей человека.
Каковы механизмы противоопухолевого действия ФНО:
- Непосредственное воздействие ФНО на опухолевую клетку-мишень через специфические ФНО-рецепторы запускает апоптоз клетки (цитотоксическое действие) или арест клеточного цикла (цитостатическое действие) . В случае ареста клеточного цикла клетка перестаёт делиться, становится более дифференцированной и экспрессирует ряд антигенов.
- Активация коагуляционной системы крови и местных воспалительных реакций, обусловленных ФНО-активированными клетками эндотелия и лимфоцитами, что ведёт к «геморрагическому» некрозу опухолей.
- Блокирование ангиогенеза . приводящее к уменьшению прорастания новыми сосудами быстрорастущей опухоли и повреждение сосудов опухоли (при этом нормальные, не опухолевые сосуды не повреждаются), что приводит к снижению кровоснабжения вплоть до некроза центральных отделов опухоли.
- Воздействие на клетки иммунной системы . цитотоксичность которых оказалась тесно связана с наличием молекул ФНО на их поверхности, или процесс созревания/активации этих клеток связан с ответом на ФНО.
 Комбинация РЕФНОТ ® с ИФН-гамма (ИНГАРОН ® ) обладают синергическим противоопухолевым эффектом при лечении опухолей - плоскоклеточных карцином и аденокарцином шейки и тела матки, гормонозависимых и гормононезависимыхаденокарцином молочной железы, мезотелиом, опухолей головы и шеи, рака лёгких, пищевода, желудка, тонкого и толстого кишечника, поджелудочной железы, печени, почек, яичников, предстательной железы, мочевого пузыря, сарком костей и мягких тканей, глиомы нервной системы, рака кожи, меланомы.
Комбинация РЕФНОТ ® с ИФН-гамма (ИНГАРОН ® ) обладают синергическим противоопухолевым эффектом при лечении опухолей - плоскоклеточных карцином и аденокарцином шейки и тела матки, гормонозависимых и гормононезависимыхаденокарцином молочной железы, мезотелиом, опухолей головы и шеи, рака лёгких, пищевода, желудка, тонкого и толстого кишечника, поджелудочной железы, печени, почек, яичников, предстательной железы, мочевого пузыря, сарком костей и мягких тканей, глиомы нервной системы, рака кожи, меланомы.Вопросами лечения раковых опухолей с помощью цитокинотерапии занимается единственная в России Клиника Онкоиммунологии и Цитокинотерапии.
РАК МОЖНО И НУЖНО ЛЕЧИТЬ!
ЭФФЕКТИВНОСТЬ И БЕЗОПАСНОСТЬ МЕТОДА ОСНОВЫВАЕТСЯ ТОЛЬКО НА ПРИНЦИПАХ ДОКАЗАТЕЛЬНОЙ МЕДИЦИНЫP.S. это не реклама препаратов, а короткий и конкретный рассказ о новейших достижениях
в лечении рака, где Время измеряется Жизнью.КЛИНИКА ОНКОММУНОЛОГИИ И ЦИТОКИНОТЕРАПИИ
г. Москва,
м. Университет, ул. Строителей д.7, корп. 1.
тел. (499)579-84-84, (495)930-88-43
БЕСПЛАТНЫЙ звонок из любого региона РФ: 8-800-100-3585Кости содержат несколько типов клеток. Остеобласты ответственны за образование основы костей, а именно, соединительной ткани и неорганических веществ (минералов), которые обеспечивают прочность костей.
 Остеокласты помогают регулировать уровень неорганических веществ в крови, влияя на отложение и удаление этих веществ из костей, что дает возможность костям сохранять необходимую форму. Костный мозг, имеющийся в некоторых костях, содержит жировые, а самое главное, гематопоэтические клетки, производящие различные клетки крови.
Остеокласты помогают регулировать уровень неорганических веществ в крови, влияя на отложение и удаление этих веществ из костей, что дает возможность костям сохранять необходимую форму. Костный мозг, имеющийся в некоторых костях, содержит жировые, а самое главное, гематопоэтические клетки, производящие различные клетки крови.Различают плоские и длинные трубчатые кости. Плоские кости помогают защищать от повреждений головной мозг и органы грудной полости, живота и таза. Например, кости черепа и грудина относятся к плоским костям, а кости верхних и нижних конечностей - к длинным трубчатым костям.
Остеосаркома является наиболее часто встречающейся опухолью костей.
Как и другие злокачественные опухоли, остеосаркома может распространяться на близлежащие ткани (мышцы, сухожилия, жировую ткань), а также через кровоток в другие кости, легкие и другие внутренние органы. Это процесс носит название метастазирование.
Чаще всего остеосаркома возникает на концевых частях длинных трубчатых костей, особенно в области коленных суставов. 80% остеосарком у детей и подростков развивается именно в этих областях. Второй по частоте локализацией остеосарком является верхний отдел плечевой кости. Однако остеосаркома может возникнуть в любой кости, включая кости таза и челюсть.
Не все злокачественные опухоли костей являются остеосаркомами. Саркома Юинга является второй по частоте злокачественной опухолью у детей и подростков. Другие опухоли обычно выявляются у взрослых и очень редко у детей. К ним относятся хондросаркома, возникающая из хряща, и злокачественная фиброзная гистиоцитома.
К доброкачественным опухолям костей относятся остеомы, хондромы, остеохондромы, эозинофильные гранулемы, фибромы, ксантомы, гигантоклеточные опухоли и лимфангиомы.
Различают несколько подтипов остеосарком с различным прогнозом заболевания.
Выделяют остеосаркомы низкой, промежуточной и высокой степенью злокачественности.
Среди остеосарком высокой степени злокачественности обнаруживают остеобластические, хондробластические, фибробластические, смешанные, мелкоклеточные и телангиэктатические варианты.
Периостальный вариант относится к остеосаркомам промежуточной степени злокачественности, в параостальный и интрамедуллярный варианты - к остеосаркомам низкой степени злокачественности.
Степень злокачественности остеосарком определяет прогноз заболевания.
Так, после полного удаления остеосаркомы низкой степени злокачественности обычно не требуется химиотерапия и исход заболевания благоприятный.
При остеосаркомах высокой степени злокачественности необходимо применение как оперативного вмешательства, так и химиотерапии. Исход заболевания у больных с остеосаркомами промежуточной степени злокачественности непостоянен.
Большинство остеосарком у детей относится к опухолям высокой степени злокачественности.
Частота встречаемости остеосаркомыЕжегодно в среднем в мире регистрируется 2-3 случая заболевания на 1 млн. населения.
В США диагностируется около 900 новых случаев остеосарком в год. Опухоли несколько чаще встречаются у лиц мужского пола по сравнению с женским.
Наиболее часто заболевают подростки и молодые люди в возрасте от 10 до 23 лет, хотя остеосаркома может возникнуть в любом возрасте.
Возраст и рост. Наивысший риск возникновения остеосаркомы отмечается в период бурного роста ребенка, а именно, в подростковом возрасте. Дети, у которых выявлена опухоль, обычно выше своих сверстников. Это указывает на взаимосвязь между быстрым ростом костей и риском возникновения остеосаркомы.
Облучение костей. У людей, перенесших лучевую терапию по поводу другой опухоли, имеется повышенный риск развития постлучевой остеосаркомы. Перенесенное облучение в молодом возрасте, а также высокие дозы лучевой терапии (свыше 60 грей), повышают риск возникновения остеосаркомы.
Рентгеновские лучи, примененные с диагностической целью, практически не влияют на риск развития остеосаркомы.
Некоторые заболевания костей. У детей и подростков с некоторыми заболеваниями костей имеется повышенный риск возникновения остеосаркомы при достижении взрослого возраста.
Болезнь Педжета является доброкачественным, но предопухолевым заболеванием, при котором поражается одна или несколько костей. Обычно заболевание возникает в возрасте старше 50 лет. В 5-10% случаев при тяжелом течении болезни Педжета развиваются костные саркомы, причем, как правило, остеосаркомы.
Остеохондромы относятся к доброкачественным опухолям костей и хряща. При наличии множественных наследственных остеохондром риск развития остеосаркомы повышен. Чем больше у больного остеохондром, тем выше риск возникновения остеосаркомы.
Наследственные опухолевые синдромы. У детей с некоторыми наследственными опухолевыми синдромами имеется повышенный риск развития остеосаркомы.У людей с синдромом Ли-Фраумени повышен риск возникновения рака молочной железы, надпочечника, опухолей головного мозга, остеосаркомы и других опухолей.
Ретинобластома относится к редким опухолям глаза у детей. В 40% случаев ретинобластомы являются наследственными. У детей с такими опухолями риск возникновения остеосаркомы повышен. В случае проведения лучевой терапии на область глаза повышается риск развития остеосаркомы костей черепа.
Выбор типа операции зависит от локализации опухоли и влияния операции на функцию пораженной части тела.
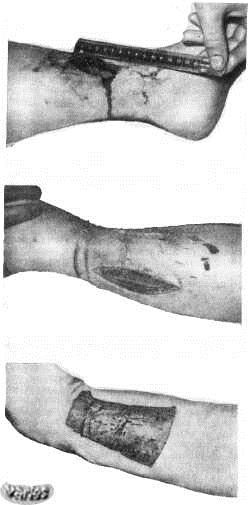 Во многих случаях пораженная кость или мягкие ткани могут быть полностью удалены хирургическим путем без нарушения функции органа. В других случаях сохранение функции органа после полного удаления опухолевой ткани невозможно.
Во многих случаях пораженная кость или мягкие ткани могут быть полностью удалены хирургическим путем без нарушения функции органа. В других случаях сохранение функции органа после полного удаления опухолевой ткани невозможно.Если много лет тому назад саркому Юинга верхних и нижних конечностей лечили с помощью ампутации, то в настоящее время чаще всего выполняются сохранные операции. При этом удаленные кости и суставы замещаются трансплантатами или протезами. Сохранные операции проводятся даже больным с поражением тазовых костей.
У больных саркомой Юинга с поражением жизненно важных нервов и сосудов вместо операции может быть применена лучевая терапия.
В случае локализации саркомы Юинга на грудной клетке выполняется удаление опухоли вместе с несколькими ребрами, которые замещаются синтетическим материалом.
Метастатические узлы в легких удаляются во время операции торакотомии. После операции таким больным проводится лучевая терапия на легочную ткань.
Из непосредственных и отдаленных последствий оперативного лечения саркомы Юинга следует отметить плохое заживление ран и инфекционные осложнения. Это объясняется ранее примененной химиотерапией и облучением. После операции многие больные саркомой Юинга нуждаются в восстановительном лечении.
Химиотерапия больным саркомой Юинга проводится с помощью противоопухолевых препаратов, вводимых, как правило, внутривенно и редко внутрь. Этот метод лечения применяется всем больным, независимо от стадии болезни.
Это объясняется тем, что даже у больных с локализованным процессом могут быть микрометастазы, выявляемые только с помощью микроскопического исследования. Поэтому отказ от химиотерапии у больных с локализованной стадией в конце концов приведет к росту этих микрометастазов.
Для химиотерапии саркомы Юинга применяются различные комбинации (сочетания) противоопухолевых препаратов, которые назначаются каждые 3-4 недели.
Сначала применяется комбинация таких препаратов, как винкристин, адриамицин (доксорубицин) и циклофосфан. После того, как проходят побочные эффекты химиотерапии, назначают вторую комбинацию, включающую ифосфамид и этопозид. Такие циклы химиотерапии повторяют 4-5 раз.
Химиотерапия может сопровождаться различными побочными эффектами в виде тошноты, рвоты, потери аппетита, облысения, поражения слизистой оболочки полости рта и мочевого пузыря, повышения восприимчивости к инфекции, нарушения менструального цикла, бесплодия, повреждения сердечной мышцы.
Самым серьезным, хотя и редким, осложнением химиотерапии может быть возникновение второй злокачественной опухоли, в частности, острого миелоидного лейкоза.
У больных саркомой Юинга применяется наружное облучение источниками высоких энергий. Эта опухоль является высоко чувствительной к облучению, и большинство больных можно излечить комбинацией химиотерапии и облучения.
 Суммарная доза лучевой терапии на очаг обычно составляет 45-55 грей. По показаниям проводится облучение легких, однако дозы лучевой терапии при этом снижаются.
Суммарная доза лучевой терапии на очаг обычно составляет 45-55 грей. По показаниям проводится облучение легких, однако дозы лучевой терапии при этом снижаются.К серьезному осложнению лучевой терапии относится нарушение роста костей. При этом, чем моложе ребенок, тем более выражены побочные эффекты и осложнения. Лучевая терапия может вызвать укорочение конечности, деформацию лица и пр.
При облучении области таза возможно поражение мочевого пузыря и толстой кишки. Лучевая терапия на область сустава может вызвать ограничение его функции за счет образования рубцов.
Побочные явления и осложнения лучевой терапии при воздействии на спинной и головной мозг проявляются через 1-2 года и заключаются в головной боли и ухудшении умственной деятельности.
Высокие дозы лучевой терапии (свыше 60 грей) в 20% случаев приводят к развитию второй злокачественной опухоли.
Трансплантация костного мозга и периферических стволовых клеток
В последнее время больным с плохим прогнозом, в частности с метастазами в кости и костный мозг, имеющим выживаемость менее 10%, применяется более интенсивное лечение - химиотерапия высокими дозами препаратов с облучением тела и трансплантацией костного мозга или периферических стволовых клеток. Такой подход позволяет излечить более 30% больных с метастатическим процессом.
После окончания лечения саркомы ЮингаПосле осуществления всей программы лечения саркомы Юинга больные должны находиться под наблюдением врачей и проходить периодическое обследование для выявления осложнений, возможного рецидива или второй опухоли.
Интервалы между посещениями врача со временем удлиняются.
Признаки и симптомы заболевания опухолей костной и хрящевой тканей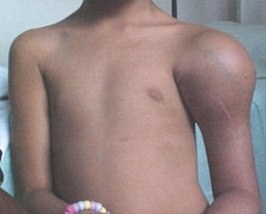 Боль в пораженной кости – самый частый симптом опухолей костей и хряща. Поначалу боль не постоянна и беспокоит больше по ночам или при ходьбе в случае поражения нижней конечности. По мере роста опухоли боль становится постоянной.
Боль в пораженной кости – самый частый симптом опухолей костей и хряща. Поначалу боль не постоянна и беспокоит больше по ночам или при ходьбе в случае поражения нижней конечности. По мере роста опухоли боль становится постоянной.Боль усиливается при движении и может привести к хромоте при наличии опухоли нижней конечности.
Припухлость в области боли может появиться через несколько недель. Иногда опухоль можно прощупать руками.
Переломы встречаются нечасто и могут возникать как в области самой опухоли, так и в непосредственной близости от нее.
Общие симптомы возникают при распространенном процессе и выражаются в виде потери веса и повышенной утомляемости.
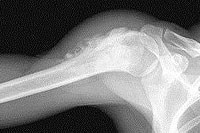
Методы диагностики опухолей костной и хрящевой тканейСтандартный рентгеновский снимок в большинстве случаев позволяет обнаружить опухоль кости, которая может выглядеть как полость или дополнительное разрастание костной ткани.
Компьютерная томография (КТ) (иногда с дополнительным введением контрастного вещества) дает возможность выявить опухоли плечевого пояса, костей таза и позвоночника.
Магнитно-резонансная томография (МРТ) особенно целесообразна при поражении позвоночника и спинного мозга.
Радиоизотопное сканирование костей с помощью технеция позволяет обнаружить как степень местного распространения опухоли, так и поражение других костей. Данный метод более эффективен по сравнению со стандартным рентгенологическим исследованием костей.
Биопсия (взятие кусочка опухоли для исследования) является обязательной, так как дает право подтвердить или исключить опухолевое поражение кости или хрящевой ткани. При этом биопсию можно выполнить иглой или во время операции.
После детального обследования уточняется стадия заболевания. В зависимости от распространенности процесса могут быть установлены стадии - от I до IV. Кроме того, исследование под микроскопом позволяет выяснить степень злокачественности опухоли.
Оперативное лечения опухолей костной и хрящевой тканейОперация является наиболее важным методом лечения костных и хрящевых опухолей. Цель хирургического вмешательства – удаление всей опухоли в пределах здоровых тканей. При возникновении опухоли в области таза оперативное вмешательство может быть затруднено из-за расположенных рядом жизненно важных органов. Если еще 10 лет тому назад возникновение злокачественной опухоли на конечности приводило к потере пораженной конечности, то в настоящее время наблюдается тенденция к сохранению конечности. Часть пораженной кости может быть удалена с последующим замещением дефекта другой костью или металлическим протезом для сохранения функции конечности. При значительных размерах опухоли сначала проводится химиотерапия или лучевая терапия, а затем после сокращения размеров опухоли выполняется сохранная операция. Ампутации (удаление конечности) выполняются нечасто. В послеоперационном периоде больному изготавливают протез. В случае метастатического поражения легких иногда производятся операции по удалению опухолевых узлов.
Лучевая терапия опухолей костной и хрящевой тканейРазличают два вида лучевой терапии при лечении опухолей костной и хрящевой тканей: наружное облучение и брахитерапию. При наружном облучении источник находится вне тела.
Лучи фокусируются на область опухоли. Брахитерапия подразумевает использование радиоактивного материала, вводимого непосредственно в опухоль. Этот вид облучения можно применять как отдельно, так и в комбинации с наружным облучением. У некоторых больных, особенно при плохом общем состоянии, лучевая терапия может оказаться основным методом лечения. У больных саркомой Юинга лучевая терапия является основным методом лечения. После нерадикальной операции лучевая терапия назначается для уничтожения оставшейся части опухоли. Облучение может быть использовано с паллиативной целью для уменьшения симптомов опухоли, например, боли.
При проведении лучевой терапии возможно появление побочных эффектов в виде изменений кожи и повышенной утомляемости. Эти явления проходят самостоятельно вскоре после окончания лечения. При облучении области таза возможно появление тошноты, рвоты и жидкого стула. Лучевая терапия, проводимая на область грудной клетки, способна вызвать повреждение легких, что в свою очередь может привести к одышке. Облучение в области верхних и нижних конечностей в ряде случаев сопровождается отеком, болью и слабостью. Лучевая терапия может усугубить побочные эффекты, вызванные химиотерапией.
Химиотерапия опухолей костной и хрящевой тканейВ зависимости от вида опухоли и стадии заболевания химиотерапия может быть использована как основное или вспомогательное (к операции) лечение.
 При этом применяется комбинация противоопухолевых препаратов. Наиболее активными препаратами при этих опухолях являются: метотрексат (в высоких дозах в сочетании с лейковорином), доксорубицин и цисплатина.
При этом применяется комбинация противоопухолевых препаратов. Наиболее активными препаратами при этих опухолях являются: метотрексат (в высоких дозах в сочетании с лейковорином), доксорубицин и цисплатина.В ряде случаев химиотерапия назначается до операции с целью сокращения размеров опухоли, в других - сразу после хирургического вмешательства для уничтожения оставшихся опухолевых клеток.
У больных с обширным распространением (метастазированием) опухоли могут применяться и другие противоопухолевые препараты: винкристин, этопозид, дактиномицин, ифосфамид.
Химиотерапия, уничтожая опухолевые клетки, повреждает также нормальные клетки, вызывая побочные эффекты и осложнения. Выраженность побочных эффектов зависит от типа препарата, общей дозы и длительности применения.
Из временных побочных эффектов можно отметить: тошноту, рвоту, потерю аппетита, облысение, появление язв во рту. Уменьшение количества эритроцитов, лейкоцитов и тромбоцитов в крови в результате повреждения костного мозга может вызывать малокровие (анемию), повышенную восприимчивость к инфекции, кровотечения.
После завершения всей программы лечения опухолей костной и хрящевой тканейПосле прекращения противоопухолевого лечения больной должен находиться под наблюдением врачей, которые могут назначить различные исследования.
Больной, со своей стороны, может помочь быстрейшему восстановлению после операции и дополнительного лечения, соблюдая разумный образ жизни.
- Если Вы курите, то бросьте эту вредную привычку. Отказ от курения улучшит Ваше самочувствие и аппетит.
- Если Вы злоупотребляли алкоголем, то сократите его количество или вообще откажитесь от спиртного.
- Употребляйте достаточное количество овощей и фруктов. Как можно больше отдыхайте.
Наблюдение у врачей дает возможность рано выявить рецидив (возврат) опухоли или метастазы, что позволяет во многих случаях провести эффективное повторное лечение
За последние 30 лет достигнуты существенные успехи в лечении остеосаркомы. В 60-е годы единственным методом лечения была ампутация конечности. В зависимости от стадии заболевания выживаемость больных в течение 2 лет колебалась от 5 до 20%. С момента внедрения эффективной химиотерапии появилась возможность применять ее до и после операции, причем в ряде случаев удавалось избежать ампутации конечности.
В настоящее время 5-летняя выживаемость больных с локализованной остеосаркомой превышает 70%. Выживаемость больных с чувствительными к химиотерапии опухолями варьирует в пределах 80-90%.
После обследования больного и уточнения стадии остеосаркомы разрабатывается план лечения. Следует иметь в виду, что в связи с редкостью остеосарком лечение нужно проводить только в специализированных отделениях, имеющих достаточный опыт.
Хирургический метод лечения остеосаркомы У больных с локализованной, но неудалимой остеосаркомой после химиотерапии, прогноз заболевания обычно неблагоприятный. К этой категории относятся больные с остеосаркомами основания черепа, позвоночника и костей таза.
У больных с локализованной, но неудалимой остеосаркомой после химиотерапии, прогноз заболевания обычно неблагоприятный. К этой категории относятся больные с остеосаркомами основания черепа, позвоночника и костей таза.Хирургическое лечение может заключаться как в удалении опухоли и сохранении конечности, так и в ампутации конечности. Операцию с сохранением конечности удается выполнить в 50-80% случаев, хотя в ряде случаев позднее приходиться прибегать к ампутации.
Для некоторых больных ампутация является единственным видом возможной операции.
Это относится к больным с обширным распространением опухоли в окружающие ткани, прорастанием сосудов и нервов. После протезирования такие пациенты имеют возможность ходить уже через 3-6 месяцев после ампутации.
Хирургическое удаление метастазов применяется у больных с поражением легочной ткани. При этом учитываются количество, размер и расположение метастазов, а также эффективность химиотерапии.
Химиотерапия относится к системным методам лечения.
Введенный в организм противоопухолевый препарат поступает в кровоток и достигает опухолевые клетки, разрушая их. В большинстве случаев больные остеосаркомой получают химиотерапию до или после операции.
При этом применяют следующие препараты: метотрексат в высоких дозах в сочетании с лейковорином, который нейтрализует препарат и предотвращает побочные эффекты, доксорубицин (адриамицин), цисплатин, карбоплатин, этопозид, ифосфамид, циклофосфамид.
Химиотерапия приводит к уничтожению опухолевых клеток.
Однако при этом повреждаются и нормальные клетки. Выраженность побочных эффектов зависит от типа препарата, дозы и длительности применения.
Из временных побочных эффектов следует отметить тошноту, рвоту, ухудшение или потерю аппетита, выпадение волос, образование язв во рту, нарушение менструального цикла, геморрагический цистит, нарушение функции почек, печени и сердца. Повреждение клеток костного мозга может сопровождаться присоединением инфекций и кровотечений.
В редких случаях химиотерапия повышает вероятность возникновения вторых опухолей, например, лейкоза, однако следует иметь в виду, что значение химиотерапии при остеосаркоме превышает риск вторых опухолей.
Для лечения больных с остеосаркомой используют наружное облучение с применением лучей или частиц высоких энергий.
Однако этот вид терапии играет ограниченную роль при остеогенной саркоме. Он может быть эффективным у больных после неполного удаления опухоли. Кроме того, лучевая терапия применяется для борьбы с болью и у пациентов в случае рецидива (возврата) опухоли после операции.
После окончания лечения остеосаркомыПосле завершения лечения больной находится под наблюдением врачей и проходит периодическое обследование: рентгенографию и компьюторную томографию грудной клетки, сканирование костей, эхокардиограмму, электрокардиограмму, аудиограмму.
В течение первого года больной посещает врача обычно каждые 2 месяца. Это позволяет своевременно выявлять побочные эффекты и осложнения и проводить соответствующее лечение, а также на ранних этапах диагностировать рецидив (возврат) опухоли.
Психологические аспекты при лечении остеосаркомыБольшинство случаев остеосарком возникает в подростковом возрасте - самом чувствительном периоде жизни человека.
Все это откладывает глубокий отпечаток на жизнь больного, в том числе на возможность посещать школу, заниматься спротом, работой и другой деятельностью. Особенно сложным периодом является первый год лечения.
Помощь членов семьи, друзей, медицинского персонала и психолога могут оказать положительное влияние на больного остеосаркомой.
Полезным может оказаться и беседы с больными, уже перенесшими лечения по поводу такого же заболевания.
Предотвращение возникновения остеосаркомыОтказ от некоторых привычек может привести к предотвращению многих видов злокачественных опухолей у взрослых. Однако таким путем предотвратить возникновение злокачественных опухолей, включая остеосаркому, у детей в настоящее время нельзя.
 Необходимо помнить, что чем раньше установлен диагноз остеосаркомы, чем лучше прогноз (исход) заболевания.
Необходимо помнить, что чем раньше установлен диагноз остеосаркомы, чем лучше прогноз (исход) заболевания.Боль в пораженной кости является наиболее частой жалобой больного. Поначалу боль не постоянна и обычно усиливается по ночам. В случае поражения нижней конечности физическая нагрузка приводит к усилению боли и появлению хромоты.
Припухлость в области боли может появиться много недель спустя.
Хотя остеосаркома делает кость менее прочной, однако переломы встречаются редко.
Телангиэктатические остеосаркомы являются редким вариантом опухоли, но в 30% случаев приводят к перелому кости.
В норме в молодом возрасте боль и припухлость являются частым явлением, поэтому во многих случаях диагноз остеосаркомы устанавливается поздно.
Рентгенография костей позволяет установить диагноз остеосаркомы, однако необходимо микроскопическое подтверждение с помощью биопсии опухоли.
Компьютерная томография (КТ) наряду с внутривенным контрастированием позволяет получить детальную структуру кости и определить объем поражения (близлежащих мышц, жировой ткани и пр.) и выбрать участок биопсии кости. КТ также дает возможность обнаружить метастазы в легких.
С помощью магнитно-резонансной томографии (МРТ) более детально изучаются мягкие ткани, опухоль и костный мозг. В ряде случаев удается обнаружить мелкие очаги остеосаркомы, что важно для планирования лечения. Это метод особенно ценен при обследовании головного и спинного мозга.
Радионуклидное сканирование костей проводится с помощью технеция-99. В результате этого исследования можно выявить поражение других костей и легочной ткани.
Под стадированием подразумевается определение степени распространения процесса
Принципиально остеосаркомы подразделяются на локализованные и метастатические.
При локализованной остеосаркоме поражена только кость и прилежащие ткани, включая мышцы, сухожилия и т.д.
В случае метастатической остеосаркомы имеется множественное поражение костей, легких (85%). Кроме того, возможно вовлечение головного мозга и других внутренних органов.
У больных с метастазами прогноз хуже, чем у пациентов с локализованным процессом. Однако в случае хирургического удаления метастазов и проведения химиотерапии прогноз улучшается.
Виды опухолей костной и хрящевой тканиРазличают первичные и метастатические (вторичные) опухоли костной и хрящевой ткани.
Первичные опухоли возникают непосредственно из кости или хряща, а метастатические поражения наблюдаются при распространении других опухолей (например, рака легкого, молочной железы, предстательной железы и пр.) в кости.
К доброкачественным опухолям костной и хрящевой тканей относятся: остеома, остеоид-остеома, остеобластома, остеохондрома, гемангиома и хондромиксоидная фиброма.
Эти опухоли не метастазируют и, как правило, не опасны для жизни больного. Оперативное удаление опухоли является единственным методом лечения, в результате которого больные полностью выздоравливают.
Остеосаркома (остеогенная саркома) является наиболее часто встречающейся первичной злокачественной опухолью кости (35%). Наиболее часто остеосаркома выявляется в возрасте от 10 до 30 лет, однако в 10% случаев опухоль диагностируется в возрасте 60-70 лет. В среднем возрасте остеосаркома возникает очень редко. Мужчины заболевают чаще женщин. Остеосаркома чаще поражает верхние и нижние конечности, а также кости таза.
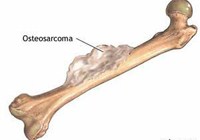 Хондросаркома развивается из хрящевых клеток и занимает второе место среди злокачественных опухолей костной и хрящевой тканей (26%). Она достаточно редко выявляется у лиц в возрасте до 20 лет. После 20 лет риск развития хондросаркомы повышается до 75 лет. Опухоль возникает с одинаковой частотой у мужчин и женщин. Хондросаркома обычно локализуется на верхних и нижних конечностях и в тазу, но может также поражать ребра и другие кости. Иногда хондросаркома развивается в результате злокачественного перерождения доброкачественной опухоли остеохондромы.
Хондросаркома развивается из хрящевых клеток и занимает второе место среди злокачественных опухолей костной и хрящевой тканей (26%). Она достаточно редко выявляется у лиц в возрасте до 20 лет. После 20 лет риск развития хондросаркомы повышается до 75 лет. Опухоль возникает с одинаковой частотой у мужчин и женщин. Хондросаркома обычно локализуется на верхних и нижних конечностях и в тазу, но может также поражать ребра и другие кости. Иногда хондросаркома развивается в результате злокачественного перерождения доброкачественной опухоли остеохондромы.Саркома Юинга названа в честь описавшего ее врача в 1921 г. Чаще всего опухоль возникает в кости, однако в 10% случаев саркому Юинга можно обнаружить в других тканях и органах. Она занимает третье место по частоте среди злокачественных опухолей костей. Наиболее часто поражаются длинные трубчатые кости верхних и нижних конечностей, реже – кости таза и другие кости. Саркома Юинга чаще всего диагностируется у детей и подростков и редко – у лиц старше 30 лет.
Фибросаркома и злокачественная фиброзная гистиоцитома (6%) развиваются из так называемых мягких тканей, к которым относятся связки, сухожилия, жировая ткань и мышцы. Обычно эти опухоли выявляются в среднем и пожилом возрасте. Верхние и нижние конечности и челюсть – наиболее частые локализации фибросаркомы и злокачественной фиброзной гистиоцитомы.
Гигантоклеточная опухоль кости может быть как доброкачественной, так и злокачественной. Чаще всего встречается доброкачественный вариант опухоли. 10% гигантоклеточных опухолей кости протекают злокачественно, что выражается в метастазировании в другие части тела, а также частом местном рецидивировании после оперативного удаления. Обычно возникают на верхних и нижних конечностях у молодых взрослых и людей среднего возраста.
Хордома возникает на основании черепа или в позвонках. Хирургическое вмешательство и применение лучевой терапии осложнены, в связи с близким расположением спинного мозга и жизненно важных нервов. После проведенного лечения больные должны находиться под тщательным наблюдением, так как возможен повторный рост (рецидив) опухоли, спустя многие годы.
Неходжкинские лимфомы (лимфосаркомы) обычно развиваются в лимфатических узлах, но иногда могут первично поражать кость.
Множественная миелома возникает из плазматических клеток костного мозга и не относится к первичным опухолям костей. Иногда процесс локализуется только в одной кости, но обычно наблюдается множественное поражение костной ткани.
Возникновение злокачественных опухолей костной и хрящевой тканиПервичные злокачественные опухоли костной и хрящевой ткани составляют менее 0,2% от всех форм рака. Максимальный уровень заболеваемости зарегистрирован в возрастной группе 75-79 лет. Риск развития злокачественных опухолей костной и хрящевой ткани в течение жизни составляет 0,12%.
Факторы риска развития злокачественных опухолей костной и хрящевой тканиПри различных формах рака могут быть свои факторы риска. Наличие одного или нескольких факторов риска еще не означает обязательное развитие опухоли. Так, у большинства больных опухолями костей и хряща нет явных факторов риска.
Ниже приводятся отдельные факторы, повышающие вероятность развития злокачественных опухолей костной и хрящевой тканей.
Наследуемые гены. У некоторых больных остеосаркомой возникновение опухоли можно объяснить наличием наследственных факторов. Синдром Ли-Фраумени предрасполагает к развитию различных опухолей, включая рак молочной железы, опухолей головного мозга, остеосаркомы и других видов сарком.
Ретинобластома является редкой опухолью глаза у детей. 6-10% ретинобластом объясняется наследственными факторами. У детей с наследственной формой опухоли повышен риск развития остеосаркомы. Проведенная лучевая терапия по поводу ретинобластомы также повышает риск возникновения остеосаркомы костей черепа.
Болезнь Педжета может поражать одну или несколько костей и считается предопухолевым заболеваниям. Эта болезнь возникает чаще всего у людей старше 50 лет. При болезни Педжета кости утолщаются, но становятся хрупкими, что может приводить к переломам. В 5-10% случаев на фоне тяжелого течения болезни Педжета развиваются костные саркомы (обычно остеосаркомы).
Множественные экзостозы (разрастание костной ткани) повышают риск развития остеосаркомы.
Множественные остеохондромы образованы костной и хрящевой тканями.
Некоторые люди наследуют повышенную частоту развития множественных остеохондром, что увеличивает риск возникновения остеосаркомы.
Множественные энхондромы развиваются из хрящевой ткани и предрасполагают к повышенному риску образования хондросаркомы, хотя этот риск и незначительный.
Радиация может приводить к повышению риска развития костных опухолей. При этом обычное рентгенологическое исследование не представляет опасности для человека. С другой стороны, высокие дозы облучения при лечении других опухолей могут повышать риск возникновения злокачественных опухолей костей. Так, лучевая терапия в молодом возрасте, а также дозы свыше 60 Грей повышают риск образования опухолей костей. Воздействия радиоактивных веществ (радия и стронция) также увеличивает риск развития опухолей костей, так как они накапливаются в костной ткани. Неионизирующее излучение в виде микроволновых и электромагнитных полей, возникающих от линий электропередач, мобильных (сотовых) телефонов и бытовой техники не связано с риском возникновения костных опухолей.

