Хирургический подход и по сей день является единственно эффективным в лечении рака почки. Роль хирургии за последние годы значительно изменилась, как по отношению к локализованным формам, так и по отношению к диссеминированным больным. С одной стороны, значительно возросли показания к резекции почки в начальных стадиях. С другой стороны, в связи с появлением схем адъювантной иммунотерапии увеличилась роль хирургии в лечении больных с метастазами и местнораспространенными формами.
Основной метод лечения рака почки - радикальная нефрэктомия -получила всеобщее признание после того, как в 1963 году Robson опубликовал сравнительно хорошие результаты хирургического лечения. Принципы выполнения радикальной нефрэктомии мало изменились и включают раннюю перевязку почечной артерии и вены, удаление почки вне фасции Герота вместе с окружающей паранефральной клетчаткой, удаление ипсилатерального надпочечника и выполнение регионарной лимфаденэктомии. Наиболее важным аспектом, является удаление почки вне фасции Герота, т.к. инвазия последней отмечается в 25% случаев. Современные исследования показали, что рутинное удаление надпочечника не всегда целесообразно, за исключением случаев, когда опухоль находится в верхнем полюсе или имеется субтотальное поражение почки Sagalowsky. Несмотря на то, что лимфаденэктомия обеспечивает более точное стадирование, ее лечебная значимость остается спорной.
Показания к нефрэктомии
Радикальная нефрэктомия остается методом выбора в лечении локальных форм рака почки. Роль резекции почки при здоровой контралатеральной почке до конца не определена. Большинство исследователей склоняется к правомочности резекции при размерах опухоли не более 3-5 см.
Радикальная нефрэктомия показана больным раком почки с опухолевой инвазией почечной и нижней полой вен (НПВ).
Радикальная нефрэктомия выполняется пациентам с солитарными метастазами в сочетании с одномоментной или последовательной резекцией последних.
Паллиативная нефрэктомия показана больным диссеминированным раком почки с целью уменьшения интоксикации, снижения интенсивности болевого синдрома, купирования профузной макрогематурии, а также пациентам, получающим лечение модификаторами биологического ответа.
Выбор хирургического доступа
Выполнение нефрэктомии возможно через несколько различных доступов. В общеурологической практике наиболее распространенным является внебрюшинный поясничный доступ в 10-12 межреберье. В онкологии предпочтение должно отдаваться трансперитонеальным доступам, среди которых наиболее универсальным является срединная лапаротомия. Ее положительными сторонами являются физиологичное положение больного на операционном столе, малая травматичность, быстрота выполнения, возможность ревизии и оперирования на всех органах брюшной полости, малого таза и контралатеральной почке, а также выполнения двухсторонней лимфаденэктомии.
Наконец, срединная лапаротомия дает возможность быстрой обработки почечных сосудов без лишних манипуляции на самой опухоли. При больших опухолях верхнего полюса, планируемой резекции печени удобным является односторонний, или двухсторонний (Шеврона) подреберный доступ. В ряде случаев возможно применение торакоабдоминального доступа. Главным требованием при любом доступе остается быстрый выход на сосудистую ножку и возможность моноблочного экстрафасциального удаления почки с паранефральной клетчаткой.
Лимфаденктомия при раке почки
Локализация лимфогенных метастазов
Распределение лимфогенных метастазов определяется особенностями лимфооттока. При наличии опухоли правой почки поражаются ретрокавальные, аортокавальные, латерокавальные и прекавальные лимфоузлы (рисунок 8). Перекрестное метастазирование отмечается редко и практически всегда сочетается с наличием гомолатеральных лимфогенных метастазов.
Метастазы опухолей левой почки преимущественно локализуются в парааортальных лимфоузлах, поражение аортокавальных и контралатеральных лимфатических узлов отмечается редко. Иногда при отсутствии метастазов в регионарных лимфоузлах выявляется поражение отдаленных лимфоузлов.
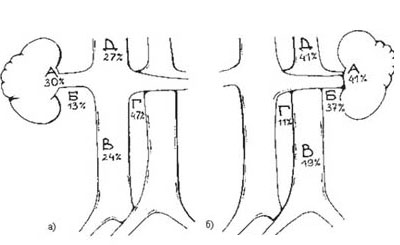
Рисунок 7. Частота метастазирования в различные группы лимфатических узлов:
а) при раке правой почки (А-лимфоузлы ворот почки, Б-латерокавальные, В-прекавальные, Г-аортокавальные, Д-ретрокавальные); б) при раке левой почки (А-лимфоузлы ворот почки, Б-латероаортальные, В-преаортальные, Г-аортокавальные, Д-ретроаортальные).
Объем лимфодиссекции при почечно-клеточном раке определяется особенностями лимфатической системы и частотой развития метастазов в различных группах лимфатических узлов. Лимфаденэктомия при раке почки подразумевает удаление всей жировой клетчатки с лимфатическими узлами, окружающей ипсилатеральные магистральные сосуды, от уровня ножек диафрагмы непосредственно ниже уровня отхождения верхней брыжеечной артерии, до бифуркации аорты и НПВ (рисунок 8).
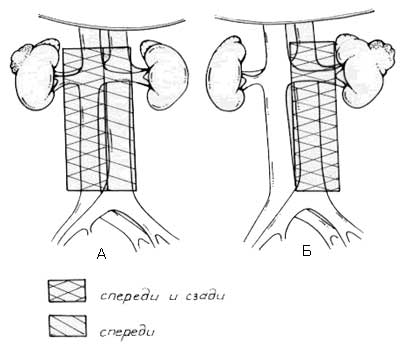
Рисунок 8. Границы расширенной лимфаденэктомии при раке правой (А) и левой (Б) почек.
Клиническое значение лимфаденэктомии
Наличие метастазов рака почки в лимфатические узлы является одним из наиболее значимых неблагоприятных факторов прогноза. Появление регионарных метастазов снижает выживаемость больных до 5-30%. Теоретически удаление пораженных лимфатических узлов может улучшить результаты хирургического лечения.
Аляевым Ю.Г. (1989) была показана четкая корреляция между стадией Т и наличием метастазов в лимфатических узлах. В связи с улучшением ранней диагностики рака почки частота обнаружения метастазов в неизмененных лимфоузлах уменьшилась с 30% в наблюдениях времен Робсона до 3.3% в группе больных, включенных в протокол EORTC № 30881, изучающий роль лимфаденэктомии. Следовательно, клиническая значимость лимфодиссекции при раке почки значительно уменьшилась, по крайне мере эпидемиологически. К сожалению, критериев отбора пациентов, которым показана лимфодиссекция, не существует. Основными аргументами в пользу выполнения лимфаденэктомии остается точное стадирование и уменьшение частоты местных рецидивов. Для ответа на вопрос, улучшает ли расширенная лимфаденэктомия выживаемость больных раком почки, требуется завершение больших рандомизированных исследований (протокол EORTC № 30881). До этого времени выполнение лимфаденэктомии не может быть рекомендовано всем больным, и решение принимается оперирующим хирургом. С целью достижения максимального лечебного эффекта следует выполнять расширенную лимфаденэктомию в соответствии с трафаретом (рисунок 10).
Хирургическое лечение рака почки с опухолевым тромбозом почечной и нижней полой вены
Термин венозная инвазия означает распространение опухоли по просвету сосудов (продолженный рост) без обязательного прорастания сосудистой стенки. Синонимом опухолевой инвазии является опухолевый тромбоз. Рак почки имеет тенденцию к формированию опухолевых тромбов с распространением последних по почечной и НПВ вплоть до правого предсердия. Венозная инвазия встречается у 4-10% больных, у 60% из которых тромб распространяется выше устьев печеночных вен.
Опухолевый тромб, чаще исходит из правой почки, что, возможно, связано с меньшей длиной правой почечной вены. Данные дооперационного обследования могут указывать на ретроградное распространение тромба по НПВ. Как правило, эта часть тромба представлена свернувшимися кровяными сгустками, а не опухолью. Опухолевый тромб может распространяться не только по почечной и НПВ, а также по печеночным, надпочечниковым и гонадным венам.
В зависимости от протяженности и отношения к печеночным венам выделяют 4 вида опухолевых тромбов НПВ: периренальные, субпеченочные, внутрипеченочные (ретропеченочные) и надпеченочные. Первые три вида относят к группе поддиафрагмальных тромбов. Надпеченочные, они же наддиафрагмальные тромбы, подразделяют на внутриперикардиальные и внутрипредсердные.
Радикальная нефрэктомия с тромбэктомией
Основным отличием тромбэктомии от просто радикальной нефрэктомии является необходимость мобилизации, контроля и резекции НПВ, что превращает обычную полостную операцию в сосудистую и может представлять определенные технические сложности. Удаление тромба при его распространении на правое предсердие особенно опасно и при некоторых видах тромбоза требует кардиопульмонального шунтирования, гипотермии с остановкой кровообращения.
Применение кардиопульмонального шунтирования показано для удаления фиксированных тромбов, распространяющихся выше диафрагмы, когда использование более простых методов опасно в отношении фрагментации опухоли и развития тромбоэмболических осложнений. В свою очередь применение искусственного кровообращения значительно усложняет операцию, увеличивает ее объем и сопряжено с высоким риском коагулопатических кровотечений вследствие гепаринизации.
В случае флотирующих опухолевых тромбов, пролабирующих в полость правого предсердия, выполнение операции возможно без применения искусственного кровообращения. В этих случаях для контроля за наддиафрагмальным отделом НПВ целесообразно использование, разработанного М.И. Давыдовым трансдиафрагмального доступа к внутриперикардиальному отделу НПВ.
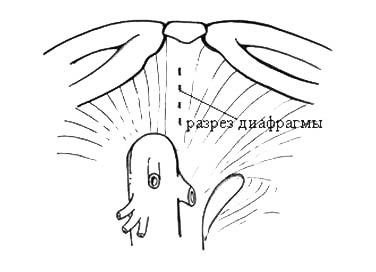
Рисунок 9. Схема трансдиафрагмального доступа
к внутриперикардиальному отделу НПВ.
Данная методика позволяет сравнительно безопасно выполнить тромбэктомию и избежать нежелательных последствий кардиопульмонального шунтирования. Доступ заключается в вертикальном рассечении диафрагмы и прилежащего к ней перикарда непосредственно над НПВ или чуть правее ее прохождения через диафрагму (рисунок 9). При этом хирург получает возможность контролировать короткий, но крайне важный внутриперикардикальный отдел НПВ, что позволяет уменьшить кровопотерю, дополнительную мобилизацию и уменьшает опасность тромбоэмболических осложнений. При внутрипеченочных тромбах, достигающих уровня диафрагмы, на внутриперикардиальный отдел НПВ может быть наложен турникет для уменьшения циркуляции во внутрипеченочном отделе НПВ. Преимущество трансдиафрагмального доступа заключается в меньшей травматичности и инвазивности, по сравнению со стернотомией и торакотомией.
У больных без отдаленных метастазов радикальная нефрэктомия с тромбэктомией обеспечивает 5-летнюю выживаемость от 47 до 64%. Наличие метастазов в лимфатических узлах и отдаленных метастазов значительно ухудшает выживаемость, в то время как уровень распространения опухолевого тромба достоверно не влияет на прогноз. Следовательно, активный хирургический подход к больным с опухолевым тромбозом НПВ является эффективным методом лечения, а радикальное удаление тромба любой протяженности даёт шанс на выздоровление большинству больных.
Осложнения радикальной нефрэктомии
Послеоперационные осложнения отмечаются у 2% больных после радикальной нефрэктомии. Неспецифические осложнения включают острый инфаркт миокарда, сердечную недостаточность, нарушения мозгового кровообращения, тромбоэмболию ветвей легочной артерии, пневмонию, ателектазы, тромбофлебиты. Частота осложнений может быть значительно уменьшена при соблюдении определенных правил предоперационной подготовки, профилактике гипотонии во время операции, проведении адекватной заместительной инфузионной терапии, дыхательной гимнастики, ранней активазации, бинтовании нижних конечностей.
Редким послеоперационным осложнением является формирование свища поджелудочной железы, как следствие ее повреждения во время операции. Послеоперационный период обычно сопровождается клиникой панкреатита и выделением сока поджелудочной железы по страховому дренажу. Отделяемое дренажа должно быть исследовано на содержание панкреатической амилазы. При неадекватном дренирорвании возможно скопление жидкости в забрюшинном пространстве с формированием панкреатической псевдокисты или абсцесса, которые визуализируются на РКТ и УЗКТ. Большинство фистул закрывается самостоятельно при хорошем дренировании.
Парез кишечника после нефрэктомии, как правило, разрешается на 3-4 сутки. Прием жидкости per os следует начинать после активизации перистальтики и самостоятельного отхождения газов. В редких случаях требуется установка назогастрального зонда.
Вторичное кровотечение сопровождается клиникой геморрагического шока, болью и пальпируемым вздутием живота, выделением крови по дренажу. Источником могут служить сосуды почечной ножки, надпочечника, брыжейки или незамеченные повреждения селезенки и печени. В подавляющем большинстве случаев для остановки кровотечения требуется релапаротомия.
Острая почечная недостаточность может развиться у больных после нефрэктомии, особенно после операций по удалению опухолевых тромбов, требующих пережатия контралатеральной почечной вены. Как правило, функция оставшейся почки восстанавливается, однако часто требуется перевод больного на временный гемодиализ.
Органосохраняющее лечение при раке почки
Резекция почки является методом выбора в случае двухстороннего опухолевого поражения и при единственно функционирующей почке. Показания к резекции могут быть расширены при наличии сопутствующей патологии контралатеральной почки, такой как мочекаменная болезнь, сахарный диабет, хронический пиелонефрит, нефросклероз. В редких случаях резекция почки выполняется при переходно-клеточном раке собирательной системы и при опухоли Вилмса, когда сохранение функционирующей паренхимы крайне необходимо.
В последние годы показания к органосохраняющему лечению еще более расширились в связи с ранней выявляемостью опухолей почки, когда их размеры не превышают 3-5см. Предварительные результаты исследований, сравнивающих резекцию при здоровой контралатеральной почке и нефрэктомию, говорят о правомочности органосохраняющего подхода при небольших размерах опухоли и удобной для резекции локализации.
Варианты органосохраняющего хирургического лечения при раке включают: энуклеацию, клиновидную резекцию, резекцию полюса, геминефрэктомию и экстракорпоральную резекцию с аутотрансплантацией почки. При любом виде резекции необходимо соблюдение следующих общих принципов: контроль за почечными сосудами, минимальное время ишемии, удаление опухоли в пределах здоровых тканей, герметичное ушивание вскрытой собирательной системы почки, тщательный гемостаз и укрывание дефекта почечной паренхимы мышечно-фасциальным, жировым или брюшинным лоскутом.
При планировании резекции почки большое значение имеет выполнение селективной почечной артериографии, за исключением случаев небольших опухолей, расположенных в области одного из полюсов почки. Знание сосудистой архитектоники почки, расположения главной почечной артерии и ее ветвей позволяет удалить опухоль с наименьшей кровопотерей и с сохранением максимального объёма функционирующей паренхимы.
Осложнения после резекции почки, в основном, связаны с техническими особенностями проведения хирургического вмешательства – мобилизацией почечных сосудов, длительностью их пережатия, объемом удаляемой почечной паренхимы, реконструкцией чашечно-лоханочной системы. Риск развития осложнений при периферически расположенных опухолях малого размера, как правило, незначителен. Наиболее частыми осложнениями являются: вторичное кровотечение, формирование мочевого свища, стриктура мочеточника, плохая функция резецированной почки и инфекционные осложнения. Профилактикой мочевых свищей является тщательное ушивание вскрытой чашечно-лоханочной системы. Большинство свищей закрывается спонтанно, однако в некоторых случаях требуется установка мочеточникового стента. Инфекционные осложнения после резекции почки обычно разрешаются самостоятельно при адекватном дренировании и отсутствии мочевой инфекции. Одновременное выполнение нефрэктомии и резекции контралатеральной почки или симультанного органосохраняющего лечения с обеих сторон опасны в отношении развития ОПН. Исключением являются периферически расположенные опухоли малого размера, при которых риск развития осложнений, как правило, незначителен, что оправдывает в некоторых случаях выполнение одномоментных операций.
Хирургическое лечение солитарных и единичных метастазов рака почки
Солитарные метастазы рака почки или метастатическое поражение только одного органа имеет место только в 3-11% случаев. Частота появления солитарных метастазов в различных органах отличается от распределения множественных. Наиболее часто поражаются легкие (30%), кости (15%), лимфатические узлы (14%), ЦНС (8%), печень (5%), надпочечник (2.7%), контралатеральная почка (1.4%), кожа (1.4%) .
Целесообразность хирургического подхода к больным с метастатическим раком почки до недавнего времени ставилась под сомнение, однако современные исследования показали, что резекция солитарных и единичных метастазов существенно улучшает выживаемость, и что не менее важно, улучшает ее качество. В первую очередь это относится к пациентам с симптоматическими поражениями скелета и головного мозга. Резекция костных поражений выполняется для коррекции и предотвращения патологических переломов, сохранения двигательной активности, устранения болей.
Активный хирургический подход более показан молодым пациентам с метастазами в трубчатых костях, при наличии патологических переломов или при угрозе их появления. Объем вмешательства варьирует и может заключаться в кюретаже со стабилизацией, резекции, резекции с эндопротезированием или просто стабилизации при планировании в дальнейшем проведения лучевой терапии. Одним из наиболее трагичных осложнений метастазов в позвоночник является развитие компрессии спинного мозга. Хирургическая декомпрессия с последующим лучевым воздействием должна рассматриваться как первоочередной метод лечения. 5- и 10-летняя выживаемость после резекции солитарных костных метастазов составляет 35% и 17% соответственно.
Метастазы в головной мозг приводят к развитию неврологической симптоматики в 98% случаев. Удаление последних сопровождается практически полным симптоматическим выздоровлением, и соответственно крайне значимым улучшением качества жизни. Радикальное хирургическое удаление метастазов из головного мозга увеличивает среднюю продолжительность жизни с 1 до 24 месяцев. При этом 12% больных живут более 5 лет после операции .
При наличии бессимптомных единичных или солитарных метастазов в легкие, печень, надпочечник, контралатеральную почку хирургическое лечение показано при возможности полного удаления первичной опухоли, отсутствии других локализаций и проявлений метастатической болезни, ограниченном и доступном для полного хирургического удаления количестве поражений. У правильно отобранной группы больных хирургическая резекция метастазов позволяет продлить жизнь до 5 и более лет. Прогностически благоприятными являются локализация метастазов только в одном органе, возможность полного удаления впервые возникших поражений, безрецидивный период после нефрэктомии более 24 месяцев и солитарный характер поражений .
Таким образом, в настоящее время появилась необходимость подразделять больных с метастазами рака почки на подгруппы в зависимости от наличия или отсутствия определенных прогностических факторов. Кроме того, учитывая паллиативную направленность большинства операций по удалению метастазов рака почки, большое значение приобретает прогнозирование ожидаемой продолжительности жизни и степени возможного паллиативного эффекта от планируемого хирургического лечения. Это, в свою очередь, позволит оптимизировать проводимую терапию. С учетом данных прогностических факторов, больший процент больных может быть подвергнут агрессивному хирургическому лечению в комбинации с иммунотерапией или без нее.
Хирургическое лечение местных рецидивов после нефрэктомии
Местные рецидивы в ложе удаленной почки встречаются редко, в 2-14% случаев. Причиной их появления является нерадикальный характер нефрэктомии и наличие метастазов в регионарных лимфатических узлах. Учитывая резистентность рака почки к химио- и лучевой терапии, хирургическое лечение остается наиболее эффективным методом лечения. Преимущества комбинированного лечения, включающего различные варианты до, интра и послеоперационной лучевой терапии спорны.
Местные рецидивы в ложе удаленной почки биологически ведут себя так же, как метастазы, и несут в себе риск местного прогрессирования и генерализации процесса. По этой причине сочетание хирургического метода с терапией модификаторами биологического ответа теоретически может улучшить результаты лечения.
Агрессивный хирургический подход к больным с местным рецидивом часто требует резекции соседних органов и объем операции, как правило, не ограничивается удалением рецидива, что обуславливает высокий процент послеоперационных осложнений. Тем не менее, хорошие показатели 5-летней выживаемости (37,7%) оправдывают проведение расширенных оперативных вмешательств у отобранной группы больных.
Лекарственное лечение метастатического рака почки
Лечение больных раком почки с метастазами представляет большие трудности, связанные с тем, что химиотерапия, так же как и лучевая терапия при раке почки неэффективны. Устойчивость почечно-клеточного рака к цитотоксической химиотерапии связана с высоким уровнем экспрессии гена лекарственной устойчивости (MDR)-1. Продукт экспрессии гена – гликопротеин Р-170, отвечает за активное выведение цитотоксических агентов и их метаболитов из опухолевой клетки.
С 1974 по 1994 гг. в 155 клинических исследованиях оценивалась эффективность более 80 различных химиопрепаратов. Средний ответ на лечение составил 4%. Наиболее эффективными (средняя эффективность 12%) оказались пиримидины (5-фторурацил, азацитидин). В настоящее время изучается эффективность нового поколения пиримидинов - capecitabine (Кселода). У больных, не ответивших на 2 линию иммунотерапии, общий ответ при использовании Кселоды составляет 8.7%.
Ведущие позиции в лечении распространенных форм рака почки занимает иммунотерапия. Выделяют следующие иммунотерапевтические подходы: 1) неспецифическая иммунотерапия с использованием цитокинов (интерфероны, интерлейкины) и других модификаторов биологических реакций. 2) адоптивная клеточная иммунотерация с применением аутолимфоцитов (ALT), лимфокинактивированных киллеров (LAK), туморинфильтрирующих лимфоцитов (TIL) 3) специфическая иммунотерация (вакцинотерапия, терапия моноклональными антителами), 4) генная терапия.
На сегодняшний день стандартом лечения метастатического рака почки является иммунотерапия с использованием интерферона-2альфа и интерлейкина-2 (ИЛ-2) по отдельности или в сочетании друг с другом. Механизм действия заключается в стимуляции фагоцитоза макрофагами, воздействием на Т лимфоциты и непосредственным цитотоксическим действием на опухолевые клетки. Суммарный ответ на иммунотерапию колеблется от 10 до 20%. Продолжительность ремиссий у подавляющего большинства пациентов невелика и составляет 6-12 месяцев, хотя у 5-7% больных с полным ответом на лечение возможно достижение длительной ремиссии. Костные метастазы и метастазы в головной мозг являются общепринятыми неблагоприятными прогностическими факторами для проведения иммунотерапии.
Особую актуальность имеет вопрос совершенствования иммунотерапевтических комбинаций за счет использования новых лекарственных средств, способных модулировать противоопухолевое действие цитокинов. Использование ретиноидов (13-цис-ретиноевой кислоты) в сочетании с интерферонами показало свою эффективность при раке шейки матки и раке кожи. К сожалению большинство исследований говорит об отсутствии преимуществ комбинированной терапии у больных раком почки.
В последнее время активно изучается возможность усиления противоопухолевой активности, как цитокинов, так и химиотерапевтических агентов, в первую очередь 5-фторурацила (5-ФУ) и гемцитабина за счет их совместного использования в комбинированном лечении распространенных форм почечно-клеточного рака. Общая эффективность подобных комбинаций, однако, не превышает 38% при медиане выживаемости 11 месяцев.
К сожалению, не существует критериев, позволяющих прогнозировать эффективность неспецифической иммунотерапии, которая в настоящее время является одним из самых распространенных и доступных методов лечения этого заболевания.
В настоящее время изучается возможность использования дендритных клеток в вакцинотерапии больных почечно-клеточным раком. Последние являются «профессиональными» антигенпрезентирующими клетками, которые представляют опухолевый антиген в комплексе с молекулой главного комплекса гистосовместимости (МНС) I класса цитотоксическим лимфоцитам и активируют последние благодаря наличию на своей поверхности костимуляторных молекул семейства В-7 (CD80, CD86).
Другим направлением в лечении метастатического рака почки, которое находится в стадии изучения, является аллогенная трансплантация стволовых клеток, приводящая к развитию реакции трансплантат против хозяина/ опухоли. Общий ответ на лечение при этом превышает 50%.
Изучается возможность усиления специфического противоопухолевого иммунитета при вакцинации аутологичными опухолевыми клетками, которые приобрели способность вырабатывать различные цитокины путем введения ex vivo в геном этих клеток соответствующих генов. Отрабатывается методика прямого интратуморального введения генов in vivo, кодирующих синтез определенных цитокинов (Ил-2, GM-CSF) или стимуляторных молекул (HLA-B7).
Принципиально новыми подходами является применение блокаторов различных факторов роста и ангиогенеза, участвующих в опухолевом патогенезе. К последним относятся хорошо известные VEGF, -EGFR, bFGF.
Несмотря на то, что рак почки резистентен к лучевому воздействию при костных метастазах лучевая терапия (ЛТ) используется с паллиативной целью: для уменьшения болей и предотвращения дальнейшей прогрессии, таким образом улучшая качество жизни. Большинство радиологов не рекомендует применять обычный режим фракционирования (2Гр). Предпочтительнее использование таких режимов как 10 x 3 Гр в течении 2 недель или 5 x 4 Гр в течении 1 недели. Анальгезирующий эффект ЛТ при дозе от 30 до 40 Гр достигается у 80% больных.
ЛТ при раке почки применяется не только для уменьшения болевого синдрома, но и для стабилизации и предотвращения патологических переломов, основой чего является реминерализация костной ткани. В основе паллиативного анальгезирующего эффекта ЛТ и рекальцификации лежат разные механизмы. Для достижения рекальцификации показано использование более длительных курсов с более мелким фракционированием и высокими дозами. Spiro & Springfield (2000) при солитарных метастазах и невозможности оперативного лечения предлагают проводить лучевую терапию в дозе 60-66 Гр и разовой дозой 2 Гр 5 дней в неделю. Другие режимы включают дозу 50Гр в 20 фракциях и 39 Гр в 13 фракциях. Выбор схемы зависит от ожидаемой продолжительности жизни пациента и локализации поражения.

