Заболеваемость и смертность от рака яичников в разных странах мира имеют тенденцию к увеличению. В России показатель заболеваемости за период 1989–1997 гг. возрос на 6,5%. Химиотерапия является одним из основных методов лечения рака яичников. В разряд активных при раке яичников лекарств входят алкилирующие агенты, антиметаболиты, антрациклины, ингибиторы топоизомераз, производные платины, таксаны. Тактика лечения рака яичников как обязательный компонент включает химиотерапию (схема 1).
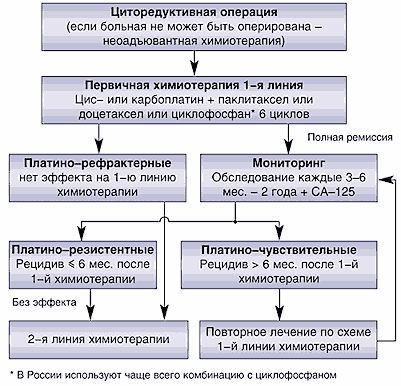
Схема 1. Тактика лечения при раке яичников
В практической медицине зачастую в качестве первой линии лечения остается комбинация цисплатина с циклофосфаном . В РОНЦ РАМН с 1992 по 1999 гг. проведено рандомизированное исследование по сравнительной оценке стандартного режима химиотерапии I линии цисплатин + циклофосфан (СР ) и комбинации циклофосфан + циклоплатам (СрС ), в которое были включены 59 больных. Циклоплатам – S(–)–малатоаммин(циклопентиламин)платина(II) представляет собой производное платины II поколения, эффективное в монорежиме у 60% больных III–IV стадией рака яичников. Общая эффективность в исследуемых группах оказалась одинаковой и составила 60% и 58,6% соответственно. Основным видом токсичности режима с цисплатином явилась нефро– и нейротоксичность, с циклоплатамом – нейтропения и тромбоцитопения. В группе СрС медиана безрецидивного периода при объективном эффекте составила 12,7 мес по сравнению с 13,5 мес в группе СР.
Кроме того, в отделении химиотерапии проведено изучение комбинации карбоплатин 300 мг/м 2 + циклофосфан 600 мг/м 2. Лечение проведено 28 больным, из них 10 пациенток получали химиотерапию на фоне цитопротектора – этиола в дозе 740 мг/м 2 с введением карбоплатина в дозе 400 мг/м 2. Эффективность в подгруппах с этиолом и без этиола составила 60% и 72,2% соответственно. В группе больных, получавших лечение с этиолом, гематологическая токсичность была низкой, а случаев глубокой тромбоцитопении и негематологической токсичности не отмечалось [1].
В последние годы особое внимание уделяется изучению преимущества схем химиотерапии с включением паклитаксела в качестве первоначального лечения.
При II фазе клинических испытаний паклитаксела выявлена его эффективность при раке яичников, и вслед за этим проведены клинические исследования эффективности комбинированных режимов.
С целью выявления преимущества комбинации паклитаксела с цисплатином (ТР ) по сравнению с принятым ранее стандартным режимом СР (циклофосфан + цисплатин) осуществлен ряд рандомизированных исследований. В исследовании GOG–111, проведенном гинекологической онкологической группой (GOG) было показано преимущество схемы ТР как по непосредственным, так и по отдаленным результатам. Эффективность составила 73% и 60%, процент полных ремиссий (ПР) – 51% и 31%, медиана безрецидивной выживаемости – 18 мес и 13 мес и медиана выживаемости – 38 мес и 24 мес, соответственно [2]. Исследование OV–10 подтвердило эти результаты [3].
Следующее исследование сравнивало ту же комбинацию ТР с монохимиотерапией паклитакселом и цисплатином – 3 «рукава» исследования по протоколу GOG–132. Результаты этого исследования не выявили какой–либо разницы в трех группах (монохимиотерапия цисплатином или таксолом или комбинацией ТР) [4]. Объяснение этому факту могло быть таким: поскольку в последующих линиях лечения в случае прогрессирования больные получали перекрестные препараты, то отдаленные результаты были одинаковыми. Эти находки подтверждают гипотезу об эквивалентности последовательного использования паклитаксела и цисплатина их одновременному применению.
GOG провела также сравнение стандартного режима ТР с более агрессивным режимом: 2 курса карбоплатина в дозе AUC 9, затем 6 курсов паклитаксела по 135 мг/м 2 24–часовой внутривенной инфузией и цисплатина 100 мг/м 2 внутрибрюшинно – GOG–114 [5]. Идея протокола была основана на данных предыдущих иcследований (GOG/SWOG–GOG–104) о преимуществе при оценке выживаемости в случае внутрибрюшинного введения цисплатина и внутривенного циклофосфана по сравнению с СР внутривенным [6]. Результаты GOG–114 продемонстрировали преимущество агрессивного режима только по медиане времени без прогрессирования (ТТР), но не по общей выживаемости [5].
Учитывая нефротоксичность цисплатина, одним из основных направлений исследований по совершенствованию химиотерапии рака яичников стало изучение комбинации паклитаксела с карбоплатином (TCb ). I и II фазы изучения, проведенные в разных странах, установили, во–первых, максимально переносимые дозы препаратов, входящих в комбинацию, и, во–вторых, лимитирующую токсичность, которой явилось угнетение кроветворения.
Максимально переносимыми дозами (МПД) были: для паклитаксела – от 135 до 275 мг/м 2. для карбоплатина – от 300 мг/м 2 до AUC 7,5 в зависимости от возможности применения гематопоэтических факторов роста.
Дальнейший ход исследований в Европе и в США был направлен на сравнение режимов ТР и TCb. Независимыми группами исследователей получены одинаковые результаты по равной эффективности сравниваемых режимов. Наибольшим из них было изучение по протоколу GOG–158, включившее 840 больных [7]. Результаты трех сравнительных рандомизированных исследований приведены в табл. 1.

Результатом этих работ явилось признание в США в качестве стандарта первой линии лечения рака яичников режима комбинированной химиотерапии паклитакселом в дозе 175 мг/м 2 3–часовой инфузией и карбоплатином в дозе, рассчитанной как AUC 5–7,5 каждые 3 нед, всего 6 циклов. Продолжающиеся затем исследования GOG были направлены на уточнение значения времени циторедуктивной операции у больных с массивными опухолями; сравнение стандартного режима ТР с паклитакселом в режиме длительных инфузий; изучение стандартного режима ТР с паклитакселом и цисплатином, вводимыми внутривенно и внутрибрюшинно [10].
Отдаленные результаты исследования по протоколу GOG–158 еще раз подтвердили значение стадии процесса, морфологического типа опухоли и степени дифференцировки опухолевых клеток, а также объема остаточных опухолевых масс после циторедуктивной операции при распространенных стадиях процесса. Независимо от схемы химиотерапии как непосредственные, так и отдаленные результаты зависели от этих параметров. Так, при ранних стадиях в случае хорошего прогноза (стадии IA, IB, grade 1 и 2) 5–летняя выживаемость составила более 95%, а при плохом (стадии IC и II, grade 3, светлоклеточный рак) – 85%. При распространенных стадиях (III и IV) в случае оптимальной циторедукции (остаточные опухоли менее 1 см) ПР составили 80–90%, полные патоморфологические ремиссии (ППР) – 50%, 5–летняя выживаемость 35–40%, а после субоптимальных циторедукций – ПР – 50%, ППР – 25%, 5–летняя выживаемость – 10% [11].
Параллельно с американскими программами Европейская кооперативная группа (ECG) провела за последние 10 лет большое число исследований при ранних и распространенных стадиях рака яичников. При ранних стадиях 2 параллельных исследования направлены на уточнение значения адъювантной химиотерапии . Одно из них (гинекологическая группа EORTC), начатое в 1990 г. включало больных I–II стадиями с рандомизацией на 2 группы – получающие платино–содержащие режимы химиотерапии или не получающие никакого специального лечения после операций. Второе – ICON–1, начатое в Англии и в Италии в 1991 г. имело ту же задачу. Набор больных закончен в 2000 г. При распространенном процессе исследование ICON–2 показало по результатам рандомизации 1526 больных одинаковые отдаленные результаты (время без прогрессирования и выживаемость) при терапии по схеме САР (циклофосфан, адриамицин и цисплатин) или же одним карбоплатином [11].
Базируясь на результатах мета–анализа об эквивалентности цисплатина и карбоплатина и с учетом нейротоксичности цисплатина, 2 рандомизированных исследования активированы в Европе по сравнению карбоплатина и цисплатина в режимах с паклитакселом: это исследование AGO (798 больных), показавшее одинаковую эффективность и улучшение качества жизни в группе получавших карбоплатин [12], и менее объемное исследование в Голландии и Дании, продемонстрировавшее сходные результаты [8].
Следующим этапом явился протокол ICON–3, начатый в 1996 г. для сравнения схемы САР, карбоплатина и комбинации TCb, включивший 2074 больных за 3 года. По первоначальным результатам, представленным на ASCO 1999 [13] и проанализированным на ESMO 2000 и на ASCO 2000 [14], не найдено различий при использовании схемы САР в дозах (500/50/50 мг/м 2 соответственно) и TCb (75/3 ч и AUC 6). Улучшение в 1% при анализе 1–летней безрецидивной выживаемости и в 2% – для 2–летней отмечено для группы TCb. Не найдено различий при анализе подгрупп, включая возраст, стадии, гистологический тип, степень морфологической дифференцировки, исследовательские центры. Имеется тенденция к улучшению результатов у больных с большими остаточными опухолями в группе TCb по оценке выживаемости (р=0,06). Период наблюдения составил 30 мес, наблюдение за 900 больными продолжается [14].
В настоящее время в Европе проведена предварительная оценка непосредственных результатов (АSCO 2001 г.) исследований EORTC–NSGO–NCIC и Германо–Франко–Австрийского исследования, сравнивающих комбинацию карбоплатин (АUС–5) + паклитаксел (175 мг/м 2 3 ч) – ТС с тройной комбинацией карбоплатин (АUС–5) + паклитаксел (175 мг/м 2 3ч) + эпирубицин (60 мг/м 2 перед паклитакселом) – ТЕС. Всего в рандомизацию была включена 1281 пациентка (1997–2000 гг.). При оценке токсичности сравниваемых режимов оказалось, что трехкомпонентная схема обладает более высокой миелотоксичностью, частотой редукций доз цитостатиков и отсрочкой лечения. Добавление в схему лечения эпирубицина не повышало частоту кардиотоксичности. По эффективности оценено 111 больных в группе ТЕС (ПР – 48%, ЧР – 38%, СБ – 11%, ПБ – 12%), 117 пациенток в группе ТС (42%, 30%, 19%, 11% соответственно). Таким образом, отмечено некоторое преимущество 3–компонентной схемы по объективному эффекту. Отдаленные результаты еще не оценены [15].
Европейская организация исследований по лечению рака EORTC проводит также сравнение неоадъювантной химиотерапии с последующей операцией и циторедуктивной операции с последующей химиотерапией.
Таким образом, все кооперированные исследования продемонстрировали высокую эффективность паклитаксел–платино–содержащих режимов.
Довольно интенсивно изучаются режимы комбинированной химиотерапии, включающие антрациклины. Это преимущественно 3–компонентные схемы, сочетающие таксаны, производные платины и эпирубицин.
При длительном лечении паклитакселом в комбинации с карбоплатином встает практическая проблема, связанная с токсичностью. Это, в первую очередь, угнетение кроветворения и, во–вторых, нарастающая нейротоксичность. И если угнетение кроветворения можно контролировать с помощью колониестимулирующих факторов роста, то нейротоксичность III–IV степени может полностью ограничить применение эффективной химиотерапии.
В этой связи чрезвычайно интересны данные, представленные на ASCO 2001 Vasey Р. и др. [16] по исследованию с доцетакселом (SCOTROC Trial).
Второй препарат из класса таксанов – доцетаксел хронологически вышел на арену при раке яичников позднее, чем паклитаксел. Однако последнее рандомизированное исследование по сравнению паклитаксела с карбоплатином (РС) и доцетаксела с карбоплатином (ДС) в качестве первой линии химиотерапии при Ic–IV стадиях эпителиального рака яичников продемонстрировало многообещающие результаты, показав менее выраженную нейротоксичность комбинации, использующей доцетаксел.
В исследование было включено 1077 ранее не леченных пациенток из 83 центров в 10 странах. Схему РС получали 538 и ДС – 539 больных. Группы больных были сравнимы по основным прогностическим факторам, таким как стадии болезни, размер остаточных опухолей, морфологическая характеристика опухолей. По классификации FIGO Ic стадия была у 7%, II – у 12%, III – у 66%, IV – у 15% больных; остаточные опухоли размерами > 2 см – у 37%, низкодифференцированные опухоли – у 54% больных. Не было различий в группах по средней интенсивности доз (98% и 98%).
При оценке химиотерапии у 485 больных эффективность обеих схем химиотерапии была одинаковой – 62% для схемы РС и 65% – для схемы ДС.
Оценка эффекта по динамике снижения уровней СА–125 у 615 больных показала аналогичные результаты – 75% эффекта для РС и 74% – для схемы ДС.
Основные различия между группами были отмечены при оценке значительной, обусловленной лечением, токсичности у 927 больных, показавшей преобладание миелотоксичности при использовании схемы ДС (однако без влияния на снижение доз и безопасность больных) и значительно большую нейротоксичность РС по сравнению с ДС: % пациентов (РС/ДС) c нейтропенией IV ст. – 55/80; c осложненной нейтропенией IV ст. – 3/9; c продолжительной нейтропенией IV ст. – 1/12; c нейропатией II–III ст. – 28/10 (табл. 2).
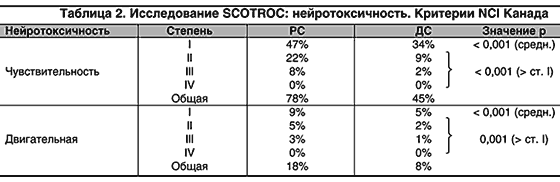
Оценка нейротоксичности самими больными по шкале оценки качества жизни также показала значительное преобладание симптомов нейротоксичности у больных, получавших комбинацию РС.
В результате данного исследования были сделаны следующие выводы:
• ДС и РС эквивалентно эффективны как по оценке клинического эффекта, так и по уровням СА–125.
• Предварительные данные показали эквивалентную 1–летнюю выживаемость.
• РС вызывает более выраженную нейротоксичность, что ведет к ранней отмене лечения и наличию продолжительных симптомов нейротоксичности у больных.
• ДС вызывает более высокий процент нейтропений по сравнению с РС; однако это осложнение можно легко контролировать, и оно не ассоциируется с увеличением частоты отмены лечения и/или токсических смертей.
Исследование показало, что доцетаксел может быть альтернативой паклитакселу в комбинации с платиновыми производными для первой линии химиотерапии рака яичников.
В отделении химиотерапии РОНЦ им. Н.Н. Блохина РАМН также проводилось изучение доцетаксела в комбинации с цисплатином у больных распространенным раком яичников. Лечение получали 65 больных эпителиальным раком яичников III–IV стадий. Химиотерапия проводилась по схеме доцетаксел 75 мг/м 2 + цисплатин 75 мг/м 2 в 1 день. Средний возраст больных 55 лет (38–73). Статус больных до лечения 0–2 (ECOG). 35 пациенткам на первом этапе было проведено оперативное вмешательство. 7 – были оперированы после 6 курсов химиотерапии, 7 – оперированы после 4 курсов и 4 – после 3 курсов. Среднее количество курсов – 6 (2–10). Общее количество курсов составило 393.
Общий эффект составил 74,6%, у 31 пациентки достигнут полный эффект (ПЭ) – 49,2%, из которых у 9 – морфологически подтвержденный эффект. У 16 пациенток – частичный эффект (ЧЭ) – 25,4%, у 10 – стабилизация (СТ) – 15,9%. Среднее время до прогрессирования – 13,5 мес.
Основные побочные эффекты: нейтропения III/IV степени – 27,9%, 8 пациенток на 18 курсах получали G–CSF, на 3 курсах отмечалась фебрильная нейтропения, которая привела к редукции доз препаратов. Анемия III/IV степени – 7,9%, тромбоцитопения I степени – 1,0%, тошнота III/IV степени – 5,6%, задержка жидкости I степени – 2,5%, диарея III/IV степени – 3,9%, стоматит I/II степени – 24,9%, артралгии и миалгии I степени – 1,8%, нейротоксичность III/IV степени – 3,1%, II степени – 17,2%, I степени – 28,1%, нефротоксичность II степени – 0,8%, I степени – 4,6%, алопеция отмечалась у всех больных после 1–2 курсов.
Предварительный анализ данных показал высокую эффективность комбинации доцетаксел + цисплатин при удовлетворительной переносимости.
На основании литературных данных и собственного опыта следующие режимы с доцетакселом могут быть рекомендованы для использования в клинической практике в качестве 1–й линии химиотерапии рака яичников: доцетаксел 60–75 мг/м 2 1–часовой инфузией + карбоплатин AUC 5–6 – каждые 3 нед или цисплатин 75 мг/м 2 с водной нагрузкой каждые 3 нед. Последний режим сопровождается менее выраженной нейтропенией.
Паклитаксел представляет интерес при использовании режимов высокодозной химиотерапии [17]. Однако преимущества этих методик окончательно не подтверждены.
Другая перспективная комбинация – это паклитаксел, карбоплатин и топотекан . разрабатываемая Engelholn S. с соавт. 2000 [18], Gordon A.N. с соавт. 1999 [19], Bolis G. с соавт. 2000 [20].
Различные стратегические возможности были испробованы с целью не допустить рецидива и удлинить полную ремиссию. К ним относились и внутрибрюшинное введение лекарств, и высокодозная химиотерапия с трансплантацией стволовых клеток и костного мозга, и продолжение поддерживающей химиотерапии стандартными курсами, и использование радиоактивных изотопов, и облучение всей брюшной полости и малого таза. Однако на сегодня ни один из этих методов отчетливо не повлиял на время до прогрессирования и на общую выживаемость больных, достигших клинической полной регрессии.
Большие надежды возлагаются на ряд новых лекарств . активных в отношении цисплатин– и паклитаксел–резистентных опухолей (табл. 3).
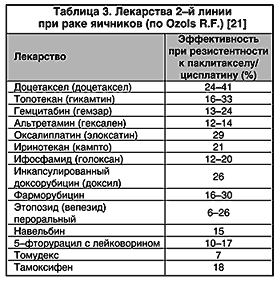
Основываясь на эффективности этих лекарств в случаях резистентности, их исследуют и в схемах первоначальной химиотерапии в качестве тройных комбинаций, например, карбоплатин + паклитаксел + гемцитабин [21] или же последовательных двойных комбинаций – цисплатин + топотекан и цисплатин + паклитаксел. Цель этих подходов – раннее воздействие на резистентные опухолевые клоны.

