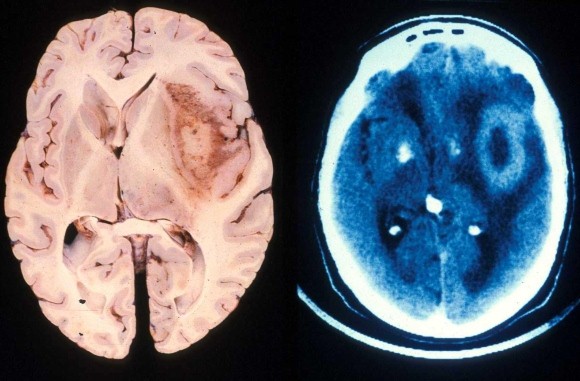
Глиома (глиобластома) – очень быстро прогрессирующая и часто смертельная опухоль головного мозга, при которой терапия имела какой-либо положительный эффект всего дважды за последние 30 лет.Но, кажется, появилась надежда. Согласно статье. опубликованной на днях в Cancer Research, исследователи, во-первых, обнаружили биомаркёр фермента, напрямую связанного с агрессивностью глиомы, во-вторых, открыли механизм регулирования этого фермента и, в-третьих, разработали для него вещество-ингибитор (подавляет активность), которое показало большую эффективность в попытках вылечить мышиную модель глиомы.
Вещество GA11 имеет структуру, которая напоминает естественный ингибитор фермента-агрессора, но чуть изменённую, настолько, чтобы оно могло пройти сквозь гематоэнцефалический барьер.
«Обе эти особенности делают GA11 привлекательным кандидатом в лекарства против глиомных стволовых клеток в мультиформной глиобластоме – крайне злокачесвенном типе опухолей головного мозга», — отмечает Ичиро Накано (Ichiro Nakano), профессор кафедры нейрохирургии, нейрохирург в Университете штата Алабама в Бирмингеме (UAB ) и один из авторов работы.
Ичиро Накано, Вито Ковьелло (Vito Coviello) и Консеттина Ла Мотта (Concettina La Motta) из Университета Пизы, Италия, провели дальнейшие доклинические исследования GA11 и его аналогов.
Мультиформная глиобластома (Glioblastoma multiforme, GBM) – очень грозное злокачественное новообразование. Согласно данным последних 30 лет, выявлено лишь два случая, когда средняя выживаемость пациентов составила от пяти до 15 или 16 месяцев, а, в основном, больные умирают очень рано.
Почему этот тип опухолей так опасен? Дело в том, что он представляет собой целую смесь клеток в разных стадиях дифференцировки, которые очень по-разному реагируют на терапию. Небольшое количество глиомных стволовых клеток GSC (наиболее активно делящихся) как раз и характеризуют злокачественность опухоли в целом, поэтому они – главные мишени для возможного лечения. Один подтип этих клеток называется мезенхимальным, и он наиболее устойчив к любого рода терапии. Именно поэтому Накано и его коллеги решили, что выявление регуляторных молекул GSC может привести к новым и эффективным методам терапии.
Исследовательская группа обнаружила, что одна из форм фермента альдегид-дегидрогеназы – ALDH1A3 – представляет выступает в качестве специфического маркёра для мезенхимальных глиомных стволовых клеток, и они первыми доказали, что среди разнородных клеток глиобластомы наиболее онкогенные те из них, которые активно экспрессируют ALDH1A3. Исследователи также обнаружили, что выработку ALDH1A3 регулирует транскрипционный фактор FOXD1. В клинических случаях с высокой степенью злокачественности уровни экспрессии этих двух веществ имели прямую зависимость с прогрессирование опухоли – те пациенты, у кого наблюдался высокий уровень экспрессии, умирали раньше, чем те, у кого он был ниже.
Когда ключ – в мушках
Удивительно, но тот же самый механизм, который управляет туморогенностью (способностью клеток тканей образовывать опухоль) в организме человека, имеет важную роль в жизни эволюционно далёких от нас организмов – плодовых мушек. Учёные нашли, что отключение мушиной версии гена, кодирующего FOXD1, или мушиной версии гена, кодирующего ALDH1A3, блокировало опухолеообразование у плодовой мушки Дрозофилы. Таким образом, этот процесс эволюционно существует уже очень давно.
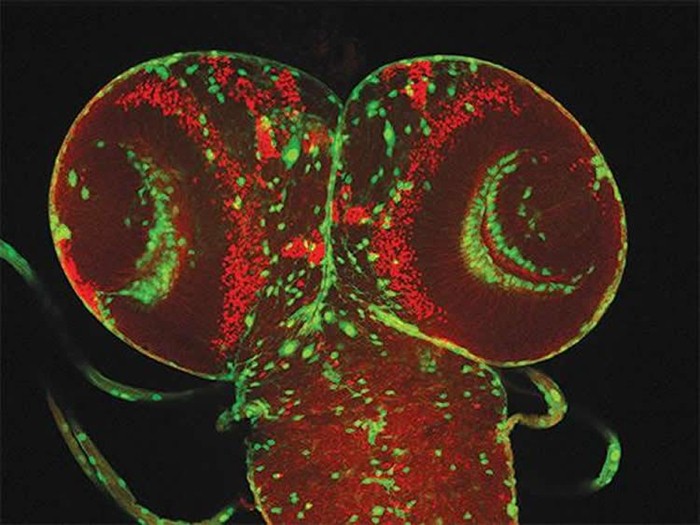
Центральная нервная система мушки-дрозофилы (зелёные – нервные клетки).Image is credited to UAB.
Фактор транскрипции FOXD1 обычно очень активно вырабатывается во время эмбрионального периода, но после рождения он должен «замолкать». Его ненормальная активность в глиобластомах говорит о том, что мезенхимальные GSC пошли по молекулярному пути обычного эмбрионального развития, отчего и стимулируется рост опухоли.
В доклинических испытаниях препарат GA11 проверили несколькими способами. Сначала исследователи доказали, что он ингибирует рост опухоли в культуре дрожжей, после чего продемонстрировали тот же самый эффект уже на мозге мышей.
Накано акцентирует внимание на том, что изучение жизнедеятельности глиомных стволовых клеток поможет найти совершенно новые и гораздо более эффективные подходы к лечению глиом. Тогда как другие лаборатории в это время пытаются проводить иммунотерапию, применять иные ингибиторы, прививки и повышать чувствительность клеток к лучевой терапии. Однако, профессор не считает, что будет эффективным только какой-то один тип лечения. Он выступает за комбинированное воздействие.
Клиника уже близко
Накано планирует запустить этап клинических испытаний препарата в 2017 году совместно с Бартом Нейборсом (Burt Nabors), профессором кафедры неврологии в Университете Алабамы. Накано говорит, что Алабама станет единственным местом на юге страны, где появится уникальная таргетная (узконаправленная) терапия глиобластом, которая отличается от стандартной.
Лаборатория Накано также работает над проблемой метастазов в головном мозге (опухолей, которые «пришли» в него из других частей тела). Летальность при метастазировании велика, так как метастазы часто бывают очень злокачественными, и существует крайне мало вариантов действенного лечения. Накано также считает, что всё дело в стволовых клетках, их генах и сигнальных путях, и это общая черта как глиом, так и метастазов, на которую можно воздействовать. Учёный отмечает, что на этом поприще также ведутся активные исследования, которые, возможно, в скором времени также перейдут в клинические испытания.

