Проблема лечения онкологических больных пожилого возраста весьма актуальна в настоящее время в силу неуклонного роста заболеваемости злокачественными новообразованиями и демографических изменений в современном обществе, проявляющихся ростом средней продолжительности жизни и увеличением группы больных пожилого и старческого возраста. В 1999 г. численность лиц пенсионного возраста составила пятую часть населения Российской Федерации (4). Значительные демографические изменения происходят и в нашем городе. По данным Госкомстата на 1 января 2001г. население Санкт-Петербурга составляло 4 млн. 628 тыс. человек и ежегодно уменьшается на 35 тыс. человек. За последние годы на 17% увеличилось число жителей в возрасте 60 лет и старше, и на 20% уменьшился удельный вес детского населения (2).
Прирост онкологической заболеваемости за 1990-1999 гг. в России составил 15,0%. Этот рост объясняется, прежде всего, неблагоприятными демографическими процессами, обусловливающими "постарение" населения. Хорошо известно, что риск выявления злокачественных опухолей увеличивается с возрастом (более 60% опухолей выявляется после 65 лет), причем максимальный уровень совокупной онкологической заболеваемости (13343,7 на 100 000 населения) в России отмечается в возрастной группе 75-79 лет (1).
На этом фоне во многих странах, в том числе и в нашей, у врачей многих специальностей наблюдается стереотипное негативное отношение к больным пожилого и старческого возраста с точки зрения проведения им лекарственного противоопухолевого лечения. Это явление связано с представлением о худшей переносимости лечения пожилыми больными, большем риске побочных токсических эффектов и необходимости редуцирования доз цитостатиков. Последнее неизбежно сопровождается снижением эффективности лечения. В результате большая группа пациентов не получает современных высокоэффективных методов терапии или получает их в редуцированной форме. Правильно ли это? Действительно ли больные пожилого и старческого возраста нуждаются в особом подходе к выбору лекарственного лечения?
Корректный ответ на этот вопрос тесно связан c:
- существованием возрастных особенностей течения опухолевого процесса
- соматическими особенностями больных пожилого возраста, которые могут оказывать влияние на эффективность и токсичность терапии.
В настоящее время имеются убедительные доказательства того, что при некоторых опухолях (острый миелолейкоз, крупноклеточная неходжкинская лимфома, опухоли яичника) действительно наблюдается ухудшение прогноза по мере увеличения возраста пациента. Механизм этих изменений только отчасти понятен и может быть связан как с изменениями опухолевых клеток, так и особенностями организма пожилых. В случае миелолейкоза это связывают с изначально большим числом резистентных к химиотерапии опухолевых клеток у пациентов пожилого возраста. В случае крупноклеточной неходжкинской лимфомы это объясняют особенностями организма, прежде всего концентрацией циркулирующего интерлейкина-6, которая увеличивается с возрастом и тесно коррелирует с прогнозом заболевания.
Второй проблемой являются соматические особенности больных в пожилом возрасте. Рассмотрим их отдельно по системам.
Возрастные изменения со стороны сердечно-сосудистой системы
включают в себя следующее (3):
- уменьшение числа миокардиоцитов (их некроз и апоптоз)
- склероз и кальциноз аортального, митрального клапанов
- диффузный субэндокардиальный и миокардиальный фиброз
- увеличение содержания интерстициального коллагена
- гипертрофию левого желудочка
- изменения проводящей системы сердца (потеря пейсмекеровских клеток - водителей ритма)
- сужение просвета, потеря эластичности коронарных сосудов и аорты, развитие атеросклеротических бляшек
- увеличение систолического артериального давления.
Около 2/3 лиц старше 65 лет имеют повышенное артериальное давление. Оценка функциональных показателей сердечно-сосудистой системы особенно важна при назначении антрациклиновых антибиотиков, сопровождающихся кардиотоксичностью, препаратов платины, требующих массивной сопуствующей гидратации.
Уже после 25 лет отмечается прогрессивные изменения в центральной нервной системе. Это проявляется постепенными изменениями в поведении, познавательной функции. В покое потребление кислорода и глюкозы головным мозгом не изменяется с возрастом, но адаптационная способность центральной нервной системы в ответ на стресс снижается. У пожилых пациентов отмечается также снижение функции периферической нервной системы, особенно в с сочетании диабетом, алкогольной интоксикацией (11). Это важно при назначении таких противоопухолевых цитостатиков, как: винкалкалоиды, эпиподофиллотоксины, таксаны, производные платины.
С возрастом бронхолегочная система претерпевает разнообразные морфологические и функциональные изменения, объединяемые понятием "сенильное легкое". Наибольшее клиническое значение имеют (11, 5):
- нарушение мукоцилиарного клиренса (снижение кашлевого рефлекса)
- уменьшение числа реснитчатых клеток, увеличение слизепродуцирующих клеток
- уменьшение количества эластических волокон (эмфизема легких)
- ухудшение бронхиальной проходимости
- снижение активности сурфактанта (поверхностно-активное вещество, содержащее фосфолипиды, препятствующее
- развитию микроателектазов)
- увеличение остаточного объема, снижение жизненной емкости легких
- уменьшение альвеолярно-капиллярной поверхности
- снижение физиологического ответа на гипоксию
- снижение активности альвеолярных макрофагов и нейтрофилов
- повышение микробной колонизации респираторных слизистых
Возрастные изменения бронхолегочной системы могут оказывать несомненное влияние на течение основного онкологического заболевания, и, в ряде случаев, требуют назначения поддерживающей терапии (антибиотики, бронхолитики, глюкокортикоиды).
В пожилом возрасте наблюдаются также изменение функции печени (11):
- снижение печеночного кровотока (примерно на 40%)
- уменьшение массы печени и способности к восстановлению поврежденных гепатоцитов
- снижение активности печеночных ферментов
- уменьшение продукции альбумина
- снижение метаболической функции
Метаболизм лекарственных препаратов в печени включает в себя активацию и дезактивацию путем цитохром Р-450-зависимых реакций (I фаза ) и реакций конъюгации (II фаза). Изменения в реакциях I фазы могут влиять на активность и токсичность противоопухолевых препаратов, метаболизирующихся посредством данного механизма (циклофосфан, ифосфамид, идарубицин). В настоящее время нет надежных клинических тестов для оценки состояния данной функции. Ввиду перечисленных возрастных изменений функции печени велика вероятность возникновения гепатотоксичности на фоне проводимой химиотерапии.
Изменения со стороны желудочно-кишечного тракта проявляются снижением моторики, секреции, уменьшением количества функционально активных клеток и абсорбции. Подобные нарушения могут быть скорректированы с помощью диеты, приема антацидов, ферментативных препаратов (11). Знание этих возрастных изменений особенно важно при назначении пероральных цитостатиков (фторпиримидины, этопозид), глюкокортикоидов.
C возрастом прогрессивно снижается резервная способность костного мозга (11). У пожилых чаще наблюдается анемия, снижение уровня гемоглобина, увеличивается количество экстрацеллюлярной жидкости. Особенно важным является неспособность костного мозга отвечать эффективно на кровопотерю или другой стресс. Количество и активность нейтрофилов с возрастом остаются стабильными, но снижается количество периферических лимфоцитов. С возрастом снижается также клеточный и гуморальный иммунный ответ на чужеродный антиген, в то время как, ответ на собственные антигены усиливается.
Одним из наиболее стойких функциональных изменений, присущих пожилому возрасту, является снижение клубочковой фильтрации. Это приводит к увеличению токсичности цитостатиков, выводимых преимущественно почками (блеомицин, метотрексат, цисплатин), а также химиопрепаратов, метаболизм которых связан с образованием активных, токсических продуктов, выделяющих через почки (ифосфамид, идарубицин, цитарабин). Определение уровня сывороточного креатинина не дает адекватной оценки функции почек. Происходящая с возрастом потеря мышечной массы приводит к уменьшению продукции креатинина и ложной нормализации его уровня.
Перечисленные соматические изменения присущие больным пожилого и старческого возраста неизбежно приводят к появлению особенностей фармакокинетики и фармакодинамики лекарственных препаратов (в том числе цитостатиков).
С точки зрения фармакокинетики большое значение имеет также увеличение жировой ткани в организме, уменьшение количества внутриклеточной жидкости, концентрации альбумина в сочетании с анемией, что приводит к увеличению объема распределения для жирорастворимых препаратов и уменьшению для водорастворимых. Следствием этого может быть повышение токсичности цитостатиков, связывающихся с белками и эритроцитами (таксанов, антрациклинов, эпиподофиллотоксинов).
Таким образом имеющиеся данные убедительно свидетельствуют, что больные пожилого и старческого возраста имеют не только целый ряд соматических особенностей, которые оказывают влияние на проведение лекарственного лечения, но характеризуются и некоторыми особенностями заболевания, которые оказывают влияние на его прогноз. Это подтверждает необходимость нестандартного подхода к этим больным при выборе и проведении лекарственного лечения.
В связи с этим очевиден вопрос: "Нужно ли лечить с помощью химиотерапии больных пожилого и старческого возраста?". Ответ также однозначен: "Нужно!". Проведение химиотерапии увеличивает продолжительность жизни и повышает его качество. Это можно проиллюстрировать на примере больных немелкоклеточным раком легкого. Рандомизированное сравнение химиотерапии винорельбином в дозе 30 мг/м2 х еженедельно с симптоматическим лечением показало, что проведение химиотерапии позволяет увеличить показатель выживаемость к концу первого года с 14% до 32%. При этом больные, получавшие лекарственное лекарственное лечение, имели лучше качество жизни.
Очевидно, и это подтверждено рядом исследователей, что пожилые онкологические больные требуют комплексного базисного обследования перед назначением химиотерапевтического лечения.
Этому вопросу посвящено немало исследований. Однако оценка их крайне затруднительна в связи с отсутствием четкого разделения пациентов на возрастные группы (60,65 или 70 лет), в результате один и тот же больной в разных исследованиях может быть отнесен к более пожилому или более молодому возрасту.
В 5 ретроспективных исследованиях оценки токсичности химиотерапии (Balducci L., 2000) не обнаружено корреляции их частоты и степени выраженности с возрастом. Эти исследования крайне важны с точки зрения демонстрации принципиальной возможности проведения химиотерапии больным в возрасте старше 70 лет. Однако они не могут быть признаны корректными в связи с тем, что во всех прослеживается подбор пациентов (selection bias). Это является причиной того, что до сих пор не сформулированы принципы назначения стандартной химиотерапии у более пожилых пациентов.
Тем не менее, остановимся подробнее на доступных данных, касающихся гематологической токсичности, которая представляется одной из наиболее важных при лечении цитостатиками.
В исследовании Gomez H. et al. (13) у больных с неходжкинской лимфомой нейтропения IV степени была в 3 раза чаще в группе пациентов старше 70лет, чем у больных в возрасте 61-69 лет. Установлено, что у пожилых пациентов выше риск летального исхода от инфекции на фоне нейтропении (7). Увеличение с возрастом частоты гематологической токсичности установлено в исследовании, проведенном у 299 женщин с раком молочной железы, получавших химиотерапию по схеме CMF (14). Токсические эффекты III степени наблюдались у 17,1% больных старше 65 лет и у 7,2% женщин в возрасте до 65 лет (рис.1). Различия статистически достоверны (р=0,004).
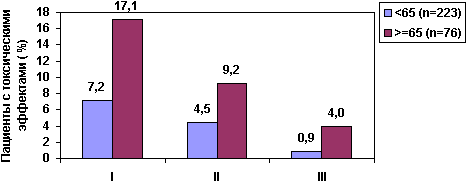
I - токсичность III степени (общая)
II - гематологическая токсичность III степени
III - мукозиты III степени
Рис.1. Увеличение частоты токсических эффектов химиотерапии в зависимости от возраста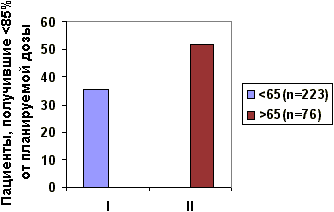
I - <65 (n=223)
II - >65 (n=76)
Рис.2. Зависимость дозы цитостатиков от возраста
Гематологическая токсичность III степени отмечена в 2 раза чаще у больных старше 65 лет (р=0,0002), а частота мукозитов в этой группе была выше в 4,5 раза (р=0,004). Токсические эффекты стали причиной редуцирования доз, в результате у 51,9% женщин старше 65 лет доза введенного цитостатика составила 85% от планируемой, в то время как, в группе моложе 65 лет только 35,4% женщин химиотерапия проведена не в полных дозах (рис.2). Таким образом, пропорция пожилых пациентов, получивших менее 85% от планируемой дозы химиотерапевтического агента, больше, чем у более молодых (р=0,0008).
Вероятность и степень нейтропении зависит не только от возраста, но и режима химиотерапии. Исследование, включающее 16580 больных с 290 различными химиотерапевтическими режимами в течении14-летнего периода (1971-1984), было проверено кооперативными онкологическими группами (15). Анализировалась степень риска тяжелой нейтропении, вызванной одним из шести цитостатических агентов (дактиномицин, винбластин, метотрексат, этопозид, CCNU, доксорубицин), в зависимости от возраста. Все пациенты были стратифицировны на три группы: младше 60 лет, 60-69 лет, 70 лет и старше. Для каждого цитостатика определялось увеличение риска нейтропении III или IV степени в двух старших возрастных группах (60-69лет и 70лет и старше) по сравнению с группой моложе 60 лет, выраженное в процентах. Самый высокий риск гематологической токсичности отмечен у дактиномицина, он оказался выше на 94% в группе 60-69 лет и на 319% в группе пациентов 70 лет и старше, чем у больных моложе 60 лет. Самой низкой гематологической токсичностью сопровождалось лечение доксорубицином: риск возникновения осложнений на 12% и 42% выше в возрасте 60-69 лет и 70 лет и старше, чем у более молодых пациентов (таб.1).
Таблица 1. Увеличение риска гематологической токсичности 3-4 степени, вызванной химиотерапевтическими агентами, в зависимости от возраста.
|
|||||||||||||||||||||||
Таким образом, перечисленные данные убедительно свидетельствуют, что химиотерапия у больных пожилого и старческого возраста сопровождается большей частотой и степенью выраженности осложнений. Лечебный эффект химиотерапии (процент пациентов с полными и частичными ремиссиями, продолжительность времени до прогрессирования заболевания и общая выживаемость) несомненно ниже у пожилых больных с хроническими заболеваниями, чем у более молодых пациентов. Существующие данные позволяют предположить, что эффективность и токсичность химиотерапии у пожилых пациентов при отсутствии тяжелой сопутствующей патологии сопоставима с более молодыми больными (7). По этой причине возраст сам по себе не является прогнозирующим фактором эффективности и токсичности лечения.
Что делать клиницисту при встрече с таким пациентом?
- Отказывать в лекарственном лечении?
- Редуцировать дозы?
- Выбирать щадящую схему?
- Проводить лечение в стандартных дозах под тщательным наблюдением?
Однозначного ответа нет. Очевидно, что нужно начать с тщательного обследования пациента. Практика показывает, что хронологический возраст далеко не всегда совпадает с биологическим. Это означает, что даже в возрасте 80 лет и старше некоторые больные могут сохранить удовлетворительные функциональные показатели и при необходимости получать стандартную химиотерапию без редуцирования доз.
При обследовании пациентов помимо обычных функциональных тестов L. Balducci , М. Extermann (1998) рекомендуют учитывать комплекс факторов. Предлагается многофакторная шкала, отражающая все виды жизнедеятельности, изменяющиеся с возрастом:
- медицинский статус (степень распространения опухолевого процесса, сопутствующие заболевания)
- функциональное состояние больного: оценка общего состояния, уровня повседневной активности (мультипараметрическая шкала ADL ) и жизнедеятельности (мультипараметрическая шкала IADL)
- познавательная деятельность (мини-ментальный статус)
- эмоциональное состояние (гериатрическая шкала депрессий)
- социальный статус
- экономический статус
- питание больного
- гериатрические синдромы
В качестве неблагоприятных прогностических факторов для лечения
выделяют:
- возраст старше 85 лет
- снижение повседневной активности по одному или более пунктам
- наличие трех или более сопутствующих заболеваний
- наличие гериатрических синдромов.
Стандартное лечение онкологическим больным в возрасте 70-75 лет может быть предложено только в случае, если они не страдают тяжелыми сопутствующими заболеваниями (12).
Если при обследовании и анализе перечисленных факторов не выявлено существенных отклонений, то больным может быть проведено стандартное лечение. При этом с целью профилактики гематологической токсичности при вычислении фактической дозы цитостатика рекомендуется учитывать показатель клубочковой фильтрации (клиренс креатинина). Для этого используется формула Коккрофта (9):
Клиренс креатинина = (140 - возраст) x вес (кг) x K / 72 x креатинин
K= 0,85 у женщин и 1,0 у мужчин
Вводимая доза цитостатика корректируется в зависимости от значения клиренса креатинина и почечной экскреции препарата. Формула Kintzel-Dorr используется для вычисления корректирующего фактора стандартной дозы цитостатика (10).
Корректирующий фактор = 1 - (f x {120 - GFR / 120}),
где f - фракция вводимого препарата и/или его активного или токсического метаболита, выделяемая через почки,
GFR - клиренс креатинина больного.
Таким образом, вводимая доза = стандартная доза x корректирующий фактор
Стандартная доза вычисляется традиционным способом в зависимости от площади тела больного.
Если при обследовании обнаружены нарушения функции или выявлена та или иная сопутствующая патология, то при выборе терапии следует:
- использовать щадящую схему
- редуцировать дозы
- отказаться от химиотерапии (в крайнем случае).
В таблице 2 приведены примеры коррекции вводимых доз цитостатиков в соответствии с клиренсом креатинина (8).
Таблица 2. Коррекция вводимых доз противоопухолевых препаратов в соответствии с клиренсом креатинина больного.
|
|||||||||||||||||||||||||||
При выявлении тех или иных нарушений функции печени рекомендуется модификация дозы цитостатиков (таблица 3).
Таблица 3. Модификация доз цитостатиков с учетом функциональных показателей печени
|
* N- верхняя граница нормального уровня общего билирубина; Vcr-винкристин, Vbl -винбластин, VP-16 - этопозид, Cph - циклофосфамид, Mtx - метотрексат, 5-ФУ - 5-фторурацил
Миелосупрессию можно контролировать путем отсрочки очередного введения химиопрепаратов, редуцированием доз, однако эти мероприятия ведут к снижению интенсивной дозы. Многочисленные исследования, проведенные при раке молочной железы, лимфопролиферативных заболеваниях, установили, что длительность выживаемости зависит от общей дозы или интенсивности дозы (мг/м2/неделю). Более надежной альтернативой модификации доз может быть профилактическое введение колонестимулирующего фактора (G-CSF, GM-CSF), с помощью которых сокращается длительность нейтропении и частота появления фебрильной нейтропении (6).
Balducci L., Yates J. (17) рекомендовали следующие основные мероприятия для уменьшения токсичности химиотерапии у пожилых онкологических больных:
- всесторонняя и полноценная оценка функционального состояния пациентов
- выбор дозы для первого цикла химиотерапии с учетом уровня клубочковой фильтрации (клиренса кретинина)
- поддержание гемоглобина на уровне 12 г/дл (при необходимости с помощью эритропоэтина)
- использование гемопоэтического фактора роста у пациентов старше 70 лет при применении комбинированной химиотерапии.
В заключении следует отметить:
- хронологический возраст пациентов далеко не всегда соответствует биологическому возрасту.
- возраст не является прогностическим признаком эффективности и токсичности лечения
- выбор оптимальной лечебной тактики у пожилых онкологических пациентов - сложный и индивидуальный процесс.
- для оценки функционального состояния пожилого больного необходимо использование многофакторной шкалы, охватывающей все сферы жизнедеятельности.
- с целью снижения риска токсичности, вызванной цитостатиками, следует прибегать к различным методам: коррекция доз, профилактическая сопутствующая терапия, пролонгированные инфузии, введение колонестимулирующих факторов, использование антидотов.

