Проблема рака обсуждается в мировой литературе уже на протяжении многих лет, однако до сих пор нет четкого определения возрастных границ для этой группы. P. Butow и соавт. (2010) в статье, посвященной психологическим проблемам больных раком молодых людей, используют определение подросткового возраста, данного Всемирной Организацией Здравоохранения, как возрастного диапазона от 12 до 24 лет [1]. Однако большинство авторов описывают возраст от 15 до 29 лет, при возможности расширяя границы до 39 лет. В частности, группа по изучению онкологической заболеваемости у подростков и молодых взрослых Национального Института Рака (США) сосредоточила свои усилия на диагностике и лечении рака у людей в возрасте от 15 до 39 лет [1,4]. В монографии A. Bleyer (2006), посвященной эпидемиологии, выживаемости и отдаленным последствиям лечения опухолей у подростков и молодых взрослых, обсуждается возраст в диапазоне 15-29 лет [9]. Несоответствия в определении границ возраста у подростков и молодых взрослых объяснимы, учитывая разное по скорости созревание биологических и психологических процессов и, соответственно, переход от периода детства к «взрослости» в западных культурах.
Факторы риска
В настоящее время установлены различные экологические, алиментарные, гормональные, инфекционные и генетические факторы риска для многих типов онкологических заболеваний, возникающих у подростков. В отличие от раковых заболеваний у пожилых людей опухоли у подростков и молодых взрослых в большей степени обусловлены генетической предрасположенностью и воздействием модифицирующих факторов риска на ранних этапах жизни [2]. Развитие неэпителиального рака с большой вероятностью ассоциировано с вирусной инфекцией, радиацией, генетическими факторами, а также влиянием многочисленных химических канцерогенов окружающей среды. Тем не менее, большинство форм рака у подростков встречаются в виде спорадических событий с неизвестной этиологией. А такие орфанные синдромы, как Ли-Фраумени, пигментная ксеродерма, атаксия-телеангиэктазия, синдромы Тернера и Беквита-Видемана связаны с повышенным риском развития рака [3]. Вероятность возникновения острых лимфобластных и нелимфобластных лейкозов в возрастном диапазоне от 5 до 29 лет среди людей с синдромом Дауна примерно в 10 раз выше, чем в остальной группе населения [4]. Нейрофиброматоз (обычно 1-го типа) несет в себе повышенный риск для опухолей центральной нервной системы и сарком мягких тканей. Наследственный синдром Ли-Фраумени, заключающийся во врожденной предрасположенности к развитию различных новообразований, в первую очередь остеогенных сарком, сарком мягких тканей, рака молочной железы, лейкемии, опухолей мозга, адренокортикальных карцином характеризуется ранним возникновением опухолей у подростков [5]. Различные виды опухолей, особенно саркомы у молодых людей, чаще встречаются в составе семейного ракового синдрома (синдрома Линча).
Инфицирование вирусом папилломы человека является установленным фактором риска развития большинства форм рака шейки матки. Доказана инициирующая роль вируса гепатита В как этиологического фактора гепатоцеллюлярной карциномы.
Крипторхизм, гидроцеле и паховая грыжа были последовательно определены как предикторы тестикулярного рака [6, 7]. Опухоли яичка имеют пик в подростковом возрасте. Восемьдесят четыре процента герминогенных опухолей встречается среди мужчин в возрасте от 15 до 44 лет, 15% - приходится на возраст 45 лет и старше, в то время, как только 1% - на возраст младше 15 лет (рис. 1).
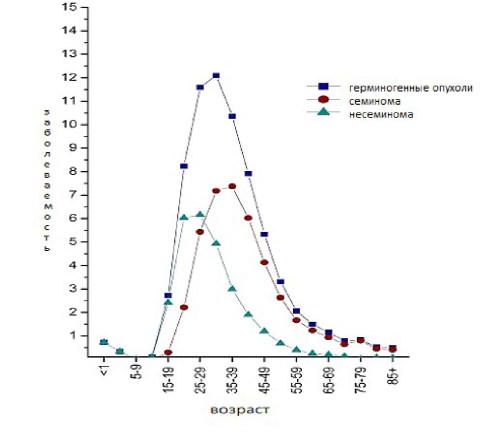
Рис. 1. Заболеваемость опухолями яичка
В 2001 г. N.E. Skakkebaek и соавт. предложили понятие «синдром тестикулярной дисгенезии», включающий в себя герминогенную опухоль яичка, нарушение сперматогенеза, крипторхизм и гипоспадию [8]. Авторы предположили неблагоприятное влияние факторов окружающей среды на развитие гонад во внутриутробной жизни плода и, возможно, на высокий риск заболеваемости раком в течение последующих нескольких десятилетий жизни молодого человека.
Щитовидная железа чувствительна к воздействию ионизирующего излучения, при этом вероятность развития рака повышается при экспозиции дозы облучения в раннем возрасте.
Эффективность лечения
Сейчас уже неоспорим тот факт, что результаты лечения больных раком молодых людей значительно хуже, чем пациентов детского и пожилого возраста. И хотя общая выживаемость у больных с опухолями резко возросла в последние годы, результаты у подростков оказались менее впечатляющими. В 70-х гг. прошлого столетия цифры общей выживаемости больных раком подростков были выше, чем у детей и пожилых пациентов, однако это преимущество снижалось в течение последующих двадцати лет и было утеряно в середине 90-х гг. Популяционный анализ эффективности лечения злокачественных опухолей в США за последнюю четверть века показал, что при более высоких темпах роста заболеваемости раком у подростков и молодых взрослых в возрасте от 15 до 45 лет значительных успехов в улучшении выживаемости в этой возрастной категории не достигнуто [9]. В частности, среднегодовое улучшение 5-летней выживаемости превысило 1,5% у детей младше 15 лет и взрослых старше 50 лет. Однако у лиц в возрасте 15-24 лет улучшение отмечено в среднем менее чем на 0,5%, а в возрасте 25-34 лет вообще не было никакого заметного прогресса [10]. Причины различий в результатах лечения подростковой и других возрастных групп не совсем ясны и, скорее всего, являются многофакторными.
Биологические особенности опухолей
Одно из объяснений отсутствия прогресса в выживаемости у подростков и молодых взрослых заключается в том, что биологические характеристики злокачественных новообразований отличаются у молодых и пожилых людей не только в спектре, но и в пределах отдельных типов опухолей. Это утверждение может быть проиллюстрировано на примере рака молочной железы (РМЖ). Среди девушек на рак молочной железы приходится 7%, при этом в данной возрастной группе отмечается самая низкая пятилетняя выживаемость - 80,2%, в то время как в возрасте 30-39 лет и 40-49 лет выживаемость составляет 83,4% и 88,9% соответственно [11]. Рак молочной железы встречается у юных женщин редко, составляя лишь 1% от всего РМЖ в возрасте до 30 лет. В структуре раковых заболеваний у девушек в возрасте до 20 лет опухоли молочной железы диагностируются в 2% случаев. «Молодой рак» молочной железы отличается более агрессивным фенотипом: характеризуется отсутствием экспрессии рецепторов эстрогенов (ER - estrogen receptor) и прогестерона (PgR - progesterone receptor); он чаще ЕR и РgR негативен, имеет инвазивный рост и высокую степень злокачественности (grade 3). «Тройной негативный» (ER(-)/PgR(-)/HER-2/neu [Human Epidermal growth factor Receptor - рецептор эпидермального фактора роста](-)) фенотип, отличающийся наибольшей летальностью, особенно характерен для девушек. Риск развития местного рецидива в этом возрасте после органосохраняющих операций в 9 раз выше, чем у пожилых. Прогресс в улучшении выживаемости больных РМЖ с 1974 г. в наименьшей степени коснулся молодых женщин. Доказано, что возраст до 35 лет является мощным независимым прогностическим фактором неблагоприятного исхода [12]. На рис. 2 представлена общая выживаемость больных раком молочной железы в зависимости от возраста. Самая низкая общая выживаемость отмечается у женщин 25-29 лет.
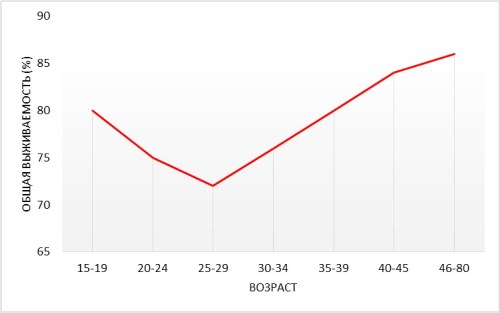
Рис. 2. Выживаемость больных РМЖ в зависимости от возраста
«Молодой» рак молочной железы является ярким примером опухоли, требующей иного подхода к терапии из-за биологических отличий, связанных с возрастом.
Социальные и психологические факторы
Социально-демографические и поведенческие характеристики уникальны для этой возрастной группы и, возможно, весьма драматичны в степени их влияния на результативность противоопухолевой терапии. Подростковый возраст - это период экспериментов с употреблением табака, алкоголя и наркотических веществ, многие из которых могут повлиять на метаболизм химиопрепаратов. Нередки случаи несоблюдения
подростками режима проводимого лечения или полного отказа от него в силу психологических особенностей этого возрастного периода. Исследование C.K. Tebbi и соавт. (1986) с участием 46 пациентов в возрасте от 2,5 до 23 лет показало, что соблюдение назначений врача достоверно коррелирует с возрастом и значительно хуже у подростков, чем у детей младшего возраста. На двадцатой неделе лечения средний возраст пациентов, часто пропускавших прием пероральных препаратов, составил 17,4 лет, изредка пропускавших назначения - 10,5 лет и выполнявших все назначения - 9,5 лет [13]. Большое значение имеет социальная пассивность и стремление к отрицанию очевидных проблем в подростковой среде. В частности, была доказана взаимосвязь между социальноэкономическим статусом и риском поздней стадии лимфомы Ходжкина (ЛХ) у молодых взрослых [14]. ЛХ составляет 12% всех новообразований в этой возрастной группе. Среди больных с низким социально-экономическим статусом отмечена большая частота поздних стадий, при которых пятилетняя выживаемость составляет 63%, в то время как у больных с I—II стадиями процесса этот показатель достигает 90%. При сравнении показателей летальности по полу выявлено, что у мужчин старше 15 лет этот показатель выше, чем у женщин. Доказано, что мужской пол является неблагоприятным фактором риска у пациентов 15-40 лет. Женщины, как известно, имеют более благоприятный прогноз заболевания в связи с преобладанием у них локализованных стадий. Ретроспективный анализ более 7000 пациентов, получавших лечение с 1998 по 2006 гг. в США, показал, что среди больных с прогрессирующей ЛХ было больше мужчин с низким социальноэкономическим статусом [14].
Выбор тактики лечения
Другой причиной неудовлетворительных результатов лечения является низкий процент включения подростков и молодых взрослых в многоцентровые исследовательские протоколы лечения опухолей, отмечаемый во всем мире [15]. По- видимому, немаловажную роль в эффективности терапии играет лечение пациентов по «детским» либо «взрослым» программам. Это утверждение может быть подтверждено на примере ЛХ и опухолей центральной нервной системы.
Лимфома Ходжкина. Летальность 15-29-летних пациентов с ЛХ составляет 4,82 случая на миллион в год. У больных в возрасте 20-24 лет летальность в 2 раза выше, чем у пациентов 15-19 лет, приближаясь к 5,23 на миллион в год (у больных 15-19 лет эта цифра равна 2,31 на миллион в год). Уровень летальности 25-29- летних достигает максимума (7,22 на миллион в год) [16].
Стандарты лечения для подростков не установлены до сих пор, поскольку они могут получать терапию как в педиатрических, так и во взрослых клиниках, практикующих разные технологии. Оба подхода считаются эффективными, так как обеспечивают длительные ремиссии и высокие показатели общей выживаемости. Современные режимы химиолучевой терапии позволяют излечить приблизительно 80% больных. Однако результаты некоторых исследований свидетельствуют о худшем прогнозе у подростков, леченных по взрослым программам [17, 18].
Различия между «детскими» и «взрослыми» подходами к лечению существенны. Согласно «взрослым» программам проводится стратификация пациентов на ранние (I и II стадии) и распространенные (III и IV стадии) формы. Подростки с распространенными стадиями, придерживаясь данной стратегии, получают 6 циклов полихимиотерапии по схеме ABVD, в то время как в педиатрических протоколах предусмотрена альтернация других схем с ABVD с целью уменьшения риска пульмо- и кардиотоксичности, а также введение в программу лечения консолидирующего облучения [17].
Не существует каких-либо рандомизированных исследований, касающихся подростков и молодых взрослых с ЛХ. Было лишь доказано, что выживаемость этой категории пациентов выше, чем больных более старшего возраста. Однако при сравнении с отдаленными результатами у детей, пятилетняя выживаемость которых превышает 90%, подобных цифр у подростков получено не было. За последние 15 лет опубликовано 79 исследований, но только в 7 из них речь идет о подгруппе подросткового возраста. В двух из них результаты лечения резко отличаются от результатов общей когорты больных [19, 20]. Французская группа в лечении ЛХ использовала новую комбинацию без антрациклинов и алкилирующих препаратов с последующим облучением зон поражения при «хорошем» ответе в дозе 20 Гр. Бессобытийная выживаемость пациентов до 9 лет составила 96%, в группе старше 9 лет - 87%, однако, различия были не достоверны и в многофакторный анализ как значимый предиктивный фактор возраст не попал [21]. L. Yung и соавт. (2004) провели ретроспективный анализ исследования выживаемости подростков с ЛХ [22]. В базе данных Британской национальной группы по исследованию лимфом оказались сведения о 209 больных в возрасте 15-17 лет, леченных в 1970-1997 гг. по «взрослым» протоколам. Пятилетняя бессобытийная выживаемость для всех стадий составила 50%. В то время, как этот показатель у детей, леченных по педиатрическим протоколам, колебался по сведениям различных исследователей от 79% до 86% [22]. Авторы пришли к выводу, что плохие результаты, вероятнее всего, связаны с лечением по принципам, типичным во взрослой практике, и с отсутствием стратификации на группы риска, как это принято в «детских» протоколах.
Опухоли мозга. J. Wolfson и соавт. (2014) проанализировали выживаемость 560 детей и 784 подростков и молодых взрослых с опухолями центральной нервной системы, получавших лечение в период с 1998 по 2008 гг. [23]. У пациентов всех возрастных групп с опухолями Grade II по классификации ВОЗ результаты лечения были хуже, если они не включались в исследовательские протоколы. Среди включенных в исследование больных выживаемость у молодых людей была хуже, чем у детей.
Фармакокинетика
Одним из факторов, потенциально влияющих на результативность лечения, является различие в фармакокинетике противоопухолевых препаратов у детей, подростков и молодых взрослых. Известно, что концентрация препарата в крови и длительность его экспозиции во многом определяют эффективность и токсичность противоопухолевой терапии. Эти параметры хорошо изучены во взрослой популяции. Однако подростки во время процесса роста и полового созревания переживают разнообразные физиологические и физические изменения, которые потенциально могут повлиять на распределение лекарственных средств. Увеличение роста и веса во время подросткового ростового скачка сопровождается полспецифичными изменениями в составе тела. Для девушек характерно большее увеличение жировой массы, в то время как у юношей преобладает прирост мышечной массы. При этом в последние годы отмечено повышение индекса массы тела среди подростков. Доказано, что подростки с высоким индексом массы тела имеют худшие результаты при лечении острого миелобластного лейкоза [24]. Ожирение не только может нарушить распределение препарата в организме из-за изменения клиренса лекарственного вещества, но и является дополнительным фактором развития лекарственных осложнений.
Обсуждается активация секреции гормона роста, инсулиноподобного фактора роста-1 (ИПФР-1) и опосредованное влияние их на метаболизм лекарственных препаратов через воздействие на половые гормоны и, в конечном итоге, активность печеночных ферментов [25]. Секреция и биологическая активность гормона роста как у мужчин, так и у женщин зависима от уровня половых стероидов. Тестостерон стимулирует центральную секрецию соматостатина и активность его на периферии, увеличивающую выброс ИПФР-
- Эстроген повышает секрецию гормона роста по принципу отрицательной обратной связи, ингибируя выброс ИПФР-1. Хотя связь концентрации гормона роста с активностью метаболизма лекарственных средств до конца не изучена, исследования показали, что экзогенный гормон роста может изменить метаболизм препарата. Одна из гипотез заключается в том, что это происходит путем влияния на экспрессию ферментов печени, принимающих непосредственное участие в метаболизме лекарств. В частности, в одном из исследований введение экзогенного гормона роста человека удлиняло время полужизни антипирина со 128 до 176% от контрольных значений [26], однако не получено убедительных доказательств зависимости метаболизма лекарственных препаратов от уровня эндогенного соматотропного гормона.
Отдаленные последствия
Благодаря достижениям современной онкологии общая выживаемость выросла во всех возрастных группах, и многие больные проживают несколько десятилетий после лечения, представляя собой когорту для исследования отдаленных последствий химио- и лучевой терапии [27]. У молодых людей, находящихся в периоде «вытягивания» и полового созревания, по сравнению с детьми не встречается нарушение роста, обусловленное воздействием ионизирующего излучения. Однако у пациентов всех возрастов повышен риск развития антрациклиновой кардиотоксичности и радиоиндуцированных вторых солидных опухолей [28, 29].
Использование в схемах полихимиотерапии блеомицина, высоких доз циклофосфамида, нитрозомочевины, бусульфана и облучение легких нередко служат причиной развития пневмофиброза. Облучение центральной нервной системы приводит к развитию таких осложнений, как церебральная атрофия, демиелинизирующие заболевания, лейкоэнцефалопатия и нейрокогнитивные расстройства. Частота развития осложнений варьирует от 30 до 70% в зависимости от возраста, дозы и сочетания с нейротоксическими препаратами (ифосфамид, метотрексат, цитарабин) [30].
Облучение средостения у девочек в возрасте 10-16 лет ведет к повышению риска развития рака молочной железы по сравнению с девочками младшего возраста, что подтверждает теорию индуцирования ионизирующим излучением солидных опухолей в растущей ткани молочной железы [31]. Цифры кумулятивной заболеваемости раком молочной железы (13,9% в 40 лет и 20,1% в 45 лет) являются поводом для пересмотра суммарных доз и полей облучения в зависимости от возраста пациентки [32].
Еще одним последствием химио- и лучевой терапии у молодых людей является нарушение фертильности. Частота, степень и продолжительность бесплодия зависят от дозы и механизма действия препарата, возраста пациента и особенностей самой опухоли. Частота бесплодия варьирует от 20 до 90% у мужчин и от 15 до 75% у женщин [5]. Облучение яичек, яичников и гипоталамо-гипофизарной области может привести к необратимой стерильности. Создание банка половых клеток, проведение заместительной гормональной терапии оказывают значительное влияние на улучшение качества жизни молодых людей.
По мере увеличения числа пациентов, излеченных от злокачественных заболеваний, стало очевидным, что за выздоровлением от первичной опухоли стоит целый спектр отдаленных последствий терапии. Через 15-20 лет после проведения лечения у пациентов намного больше шансов умереть от вторичных опухолей и сердечнососудистых заболеваний, чем у их здоровых сверстников [30].
Выводы
За последние 30 лет в мире не было достигнуто прогресса в лечении опухолевых заболеваний у больных в возрасте 15-29 лет. Существует несколько объяснений данного факта:
- отсутствие четкого понимания о выборе необходимой стратегии («детской» или «взрослой») при лечении различных неоплазий в данной возрастной группе;
- недостаток знаний об особенностях фармакокинетики и фармакодинамики противоопухолевых лекарственных средств у подростков;
- особенности биологии опухолей у молодых пациентов;
- недостаток внимания к психологическим особенностям переходного возраста, зачастую приводящим к нарушению комплайнса.
Создание многоцентровых исследовательских групп по лечению злокачественных новообразований у подростков и молодых взрослых, более активное включение пациентов данной группы в исследования позволят со временем добиться лучших результатов выживаемости и снижения частоты отдаленных последствий у больных в возрасте 15-29 лет.
Авторы статьи: Иванова С.В., Карицкий А.П., Кулева С.А., Фасеева Н.Д.

